
【题目】查阅以下有关焊锡(锡和铅)和武德合金(铅、铋、锡、镉)组成的合金熔点数据,你能得出的结论是( )
纯金属 | 合金 | |||||
铅 | 镉 | 铋 | 锡 | 焊锡合金 | 伍德合金 | |
熔点 | 327 | 321 | 271 | 231 | 187 | 70 |
A.焊锡的熔点比锡和铅的熔点低
B.焊锡的熔点比锡和镉的熔点低
C.焊锡的熔点比锡和铋熔点低
D.焊锡的熔点比铅、镉、铋和锡的熔点都低
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】如图在A中放入干燥的细铜丝,左边烧杯中放入热水,试管B中放入乙醇,右边试管C中放入冷水。向B中不断鼓入空气,使乙醇蒸气和空气通过加热至红热的铜丝。
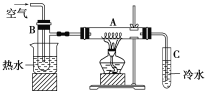
(1)A的名称为________,热水的作用是____________,本实验的目的是__________。
(2)检验乙醇中是否有水的方法为_____________,除去其中水的方法为__________;撤去A处酒精灯后铜丝仍能保持红热的原因是____________________________。
(3)反应后将试管C中的液体冷却,取出少量,滴加几滴银氨溶液,再水浴加热一段时间观察到的现象为_________________;反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚—A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:
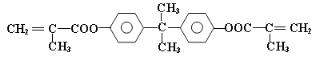
它在一定条件下水解可生成双酚—A和羧酸H两种物质。
I.(1)双酚—A的分子式为____________。下列有关它的叙述中正确的是________。
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中最多有13个碳原子在同一平面上
D.1mol 双酚—A与溴水反应,最多消耗Br2的物质的量为4mol
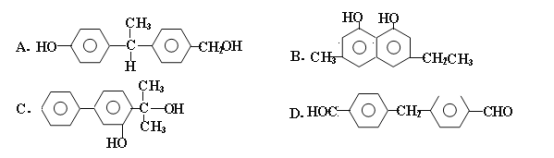
(2)下列物质中与双酚—A互为同分异构体的是_________(填序号)。
II.已知醛能被催化氧化为羧酸。
![]()
羧酸H可以由以下途径制得(有的反应条件没有标出):
![]()
(3)C的结构简式为__________________。
(4)G中所含官能团为____________(填名称),G→H的反应类型为__________。
(5)E→F的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某研究小组用下图所示的实验装置,利用氢氧化钠固体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理:2NH3(g) + CO2(g)=H2NCOONH4(s) ΔH<0。
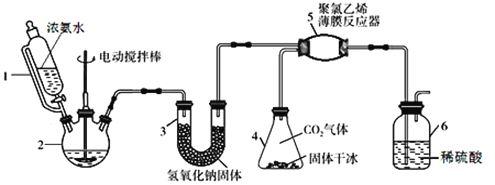
(1)实验室用98%的浓硫酸配制15%的稀硫酸,除量筒外还需使用下列仪器中的____。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)仪器1恒压分液漏斗,其优点是__________________________。
(3)仪器3中NaOH固体的作用是__________________________。
(4)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(5)另有一种制备氨基甲酸铵的反应器(CCl4与液体石蜡均为惰性介质)如图。生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。
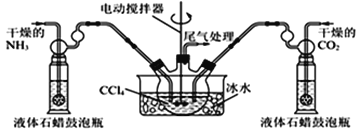
①发生器用冰水冷却的原因是________________________________________;
②从反应后混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_____(填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(6)已知氨基甲酸铵可完全水解,其中产物有碳酸氢铵。氨基甲酸铵水解反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③B.②③④C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO ![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H________0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________________。
(3)假设在密闭容器中发生上述反应,投入相等的反应物,反应刚开始时下列措施能提高NO反应速率的是_______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,催化剂比表面积会影响化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在下表中填入剩余的实验条件数据。
实验 编号 | T/℃ | NO初始浓度 mol·L-1 | CO初始浓度 mol·L-1 | 催化剂的比表面积 m2·g-1 | 达到平衡的时间 分钟 |
Ⅰ | 280 | l.20×10-3 | 5.80×10-3 | 82 | 200 |
Ⅱ | l.20×10-3 | 124 | 120 | ||
Ⅲ | 350 | 5.80×10-3 | 124 | 5 |
通过这3组实验,可以得出的温度、催化剂比表面积对化学反应速率的影响规律是___________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A. 混合酸中NO3-物质的量为0.4mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为5 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com