
【题目】用光洁铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,则无色溶液中
A.只有Na+B.一定有Na+,可能有K+
C.一定有Na+和K+D.可能有Na+和K+
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
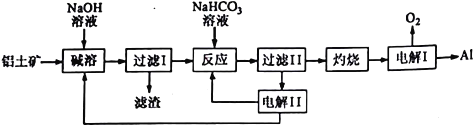
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)A1的原子结构示意图为_______________;A1与NaOH溶液反应的离子方程式为______________________________________。
(2) “碱溶”时生成偏铝酸钠的离子方程式为_______________________________。
(3)向” 过滤Ⅰ所得滤液中加入NaHCO3溶液,溶液的pH_________(填“增大”、“ 不变”或“减小”)。
(4) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是__________________。
(5)”电解Ⅱ原理如图所示。
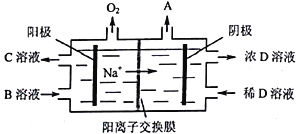
①试写出A、B、C、D物质的化学式:A_______,B_______,C_______,D_______。
②阳极的电极反应式为______________________________。
(6)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A. 15.6gNa2O2与过量CO2反应时,转移的电子数为0.2NA
B. 常温下,5.6g铁粉加入足量浓硝酸中反应,转移的电子数为0.3 NA
C. 常温下,4gCH4含有NA个C-H共价键
D. 分子总数为NA的ClO2和CO2混合气体中含有的氧原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):4FeS2+11O2→2Fe2O3+8SO2。
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为________。
(2)设1t纯净的FeS2完全反应,产生标准状况下SO2________m3。
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
(1)实验室中少量的钠通常保存在_______中,在实验室中取用钠的仪器是________.
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成 色的固体,写出该产物与H2O反应的化学方程式:________.
(3)将金属钠投入水中,发生反应的离子方程式为________
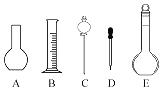
(4)该同学在实验室欲配制500mL0.1mol/L NaOH溶液.
①配制溶液时肯定不需要如图所示仪器中的________(填字母),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称).
②根据计算,该同学应用托盘天平称取NaOH的质量为________.
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L.下列操作会引起所配浓度偏大的是________.
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
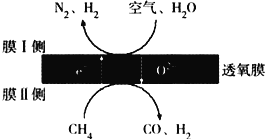
①起还原作用的物质是_________________________。
②膜I侧所得气体![]() =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________

A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0molN2和23.0molH2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。
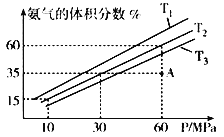
①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。

A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
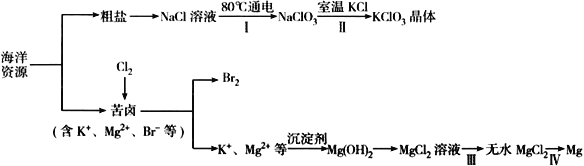
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3 晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2 溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_________
A.H2 B.N2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L 海水中95%溴元素被氧化为Br2 经热空气吹出,溴单质残留量3%。最后用SO2 将90%Br2 还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com