
【题目】原电池是化学对人类的一项重大贡献。

(1)某兴趣小组为研究原电池原理,设计如图装置。
①a和b不连接时,烧杯中发生反应的离子方程式是__________________。
②a和b用导线连接,Cu极为原电池__极(填“正”或“负”),该电极反应式是_,溶液中的H+移向_____(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是_______(填“a”或“b”)电极,该极的电极反应式为: ________
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)
【答案】Zn+2H+=Zn2++H2↑ 正 2H++2e-=H2↑ Cu 6.5 a CH4+10OH--8e-=CO![]() +7H2O 减小
+7H2O 减小
【解析】
(2)根据图示可知CH4转化为CO![]() 发生氧化反应,所以通入CH4的一极为负极,通入氧气的一极为正极。
发生氧化反应,所以通入CH4的一极为负极,通入氧气的一极为正极。
(1)①a和b不连接时,烧杯中发生锌与硫酸的置换反应,离子方程式为Zn+2H+=Zn2++H2↑;
②a和b用导线连接,Cu电极上发生氢离子得电子的还原反应,为原电池的正极;电极反应式为2H++2e-=H2↑;原电池中阳离子流向正极,所以氢离子移向Cu极;
③无论是否连接a和b,Zn都发生Zn-2e-=Zn2+,所以转移0.2mol电子时,有0.1molZn转化为Zn2+,质量减轻0.1mol×65g/mol=6.5g;
(2)①该电池中CH4失电子发生氧化反应,所以a电极为负极;电解质溶液为碱性,所以电极反应式为CH4+10OH--8e-=CO![]() +7H2O;
+7H2O;
②甲烷燃料电池的总反应式为CH4+2O2+2OH-= CO![]() +3H2O,反应中OH-参加反应导致溶液中c(OH-)减小,溶液的pH减小。
+3H2O,反应中OH-参加反应导致溶液中c(OH-)减小,溶液的pH减小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式____________(△H可用E1、E2、E3表示)。

(2)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓

①装置中H+向________池迁移。
②乙池溶液中发生反应的离子方程式:____________
(3)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g)![]() N2O2(g)(快);
N2O2(g)(快);![]() <0 v1正=k1正 c2(NO) 、v1逆=k1逆 c(N2O2)
<0 v1正=k1正 c2(NO) 、v1逆=k1逆 c(N2O2)
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢)
2NO2(g)(慢) ![]() 2<0 v2正=k2正 c(N2O2)c(O2) v2逆=k2逆 c2(NO2);
2<0 v2正=k2正 c(N2O2)c(O2) v2逆=k2逆 c2(NO2);
在一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数=___________(用含K1正、K1逆、K2正、K2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数=___________(用含K1正、K1逆、K2正、K2逆的代数式表示)。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为____。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.已知0.1 mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液
CH3COO-+H+,加少量烧碱溶液可使溶液 增大
增大
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O![]() H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C.室温下向10 mL pH=3的醋酸溶液中加水稀释后,溶液中![]() 不变
不变
D.0.1 mol·L-1的醋酸加水稀释后,溶液中所有离子的浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)写出H2CO3电离方程式_________平衡常数表达式Ka1(H2CO3)=__________________
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________
(3)①CH3COO-、②HCO3-、③CO32-、④ClO-结合H+的能力由强到弱的顺序为(注意:用序号①、②、③、④作答)____________________
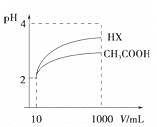
(4)体积为10mLpH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。
(5)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是()
实验目的 | 实验操作 | |
A | 除去MgCl2溶液中的少量FeCl3 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后,过滤 |
B | 验证乙醇和浓硫酸可以制备乙烯 | 乙醇和浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 |
C | 比较HClO和CH3COOH酸性 | 用pH试纸测定浓度均为0.1mol/L的HClO溶液和CH3COOH溶液的pH |
D | Mg(OH)2可溶解于饱和NH4Cl溶液 | 将NH4Cl固体与Mg(OH)2混合 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化为放热反应的是( )
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H 能正确表示物质的标准燃烧热的是
A.CO(g)+ ![]() O2(g)=CO2(g) △H =-283 kJ/mol
O2(g)=CO2(g) △H =-283 kJ/mol
B.C(g)+ ![]() O2(g)=CO(g) △H =-110.5 kJ/mol
O2(g)=CO(g) △H =-110.5 kJ/mol
C.H2(g)+ ![]() O2(g)=H2O(g) △H =-248.1 kJ/mol
O2(g)=H2O(g) △H =-248.1 kJ/mol
D.2C2H2(g)+5O2(g)=2H2O(l)+4CO2(g) △H =-2300 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com