
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
¢ŁČōĘšŹ¼ÅØ¶Č·Ö±šĪŖc(CO)=3 mol”¤L-1,c(H2O)=0.75 mol”¤L-1Ź±£¬“ļµ½Ę½ŗāŗóCOµÄ×Ŗ»ÆĀŹĪŖ20%”£
¢ŚČōĘšŹ¼ÅØ¶Č·Ö±šĪŖc(CO)=3 mol”¤L-1,c(H2O)=4.5 mol”¤L-1Ź±£¬“ļµ½ŠĀĘ½ŗāŗóCOµÄ×Ŗ»ÆĀŹĪŖ60%”£
ŹŌĶعż·ÖĪöŗĶ¼ĘĖćĶź³ÉĻĀĮŠĪŹĢā£ŗ
ŌŚ830 KŹ±£¬ĻÖŅŌĘšŹ¼ÅØ¶Č·Ö±šĪŖc(CO)=a mol”¤L-1,c(H2O)=b mol”¤L-1Ķ¶ĮĻ£¬·¢ÉśŅŌÉĻ·“Ó¦£¬²āµĆĘ½ŗāŗóc(H2)=c mol”¤L-1”£
£Ø1£©Ń”Ōń»Ų“š£ŗŌŚ¶ą“ĪŹµŃéÖŠ£¬Čō±£³Öb²»±ä¶ų¼õŠ”a£¬Ōņ“ļµ½Ę½ŗāŗóCOµÄ×Ŗ»ÆĀŹ____________£¬H2OµÄ×Ŗ»ÆĀŹ_______________”£
A.Ōö“ó B.¼õŠ” C.²»±ä D.ĪŽ·ØČ·¶Ø
£Ø2£©µ±a=4,c=1.5Ź±£¬b=__________________”£
£Ø3£©µ±a=2bŹ±£¬a”Ćc=___________________”£
£Ø4£©a”¢b”¢cŌŚøĆĘ½ŗāĢåĻµÖŠµÄ¹ŲĻµŹ½ĪŖ________________________”£
£ØĢįŹ¾£ŗĻČ·Ö±š¼ĘĖćĮ½ÖÖĒéæöĻĀĖ®µÄ×Ŗ»ÆĀŹ£¬ÕŅ³öCO”¢H2O×Ŗ»ÆĀŹÖ®¼äµÄŹżĮæ¹ŲĻµ£©
½āĪö£ŗµ±ĪĀ¶Č²»±äŹ±£¬¶ŌÓŚæÉÄę·“Ó¦
CO(g)+H2O(g)![]() CO2(g)+H2(g)£ŗ
CO2(g)+H2(g)£ŗ
¢Łµ±cŹ¼(CO)=3 mol”¤L-1£¬cŹ¼(H2O)=0.75 mol”¤L-1Ź±£¬“ļĘ½ŗāŗó£¬COµÄ×Ŗ»ÆĀŹĪŖ20%£¬ŌņH2OµÄ×Ŗ»ÆĀŹĪŖ![]() ”Į100%=80%”£
”Į100%=80%”£
¢Śµ±cŹ¼(CO)²»±ä£¬cŹ¼(H2O)=4.5 mol”¤L-1Ź±£¬“ļĘ½ŗāŗó£¬COµÄ×Ŗ»ÆĀŹĪŖ60%£¬ŌņH2O×Ŗ»ÆĀŹĪŖ![]() ”Į100%=40%”£
”Į100%=40%”£
£Ø1£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖ£¬µ±c(CO)²»±äŹ±£¬c(H2O)Ōö“ó£¬ŌņCOµÄ×Ŗ»ÆĀŹŌö“ó£¬H2OµÄ×Ŗ»ÆĀŹ¼õŠ”£¬µ«¶žÕßµÄ×Ŗ»ÆĀŹÖ®ŗĶ±£³Ö²»±ä£¬µČÓŚ1”£Ķ¬Ąķµ±c(H2O)²»±äŹ±£¬c(CO)Ōö“ó£¬ŌņCOµÄ×Ŗ»ÆĀŹ¼õŠ”£¬H2OµÄ×Ŗ»ÆĀŹŌö“󣬶žÕßµÄ×Ŗ»ÆĀŹÖ®ŗĶČŌ±£³Ö²»±ä”£
£Ø2£©µ±cŹ¼(CO)=4 mol”¤L-1Ź±£¬COµÄ×Ŗ»ÆĀŹĪŖ![]() ”Į100%=37.5%£¬Ōņ
”Į100%=37.5%£¬Ōņ
![]()
£Ø3£©COµÄ×Ŗ»ÆĀŹĪŖ![]() ”Į100%,H2OµÄ×Ŗ»ÆĀŹĪŖ
”Į100%,H2OµÄ×Ŗ»ÆĀŹĪŖ![]() ”Į100%,ŅņĪŖ
”Į100%,ŅņĪŖ![]() ”Į100%+
”Į100%+![]() ”Į100%=1,ĖłŅŌc=
”Į100%=1,ĖłŅŌc=![]() a”£a”Ćc=3”Ć1”£
a”£a”Ćc=3”Ć1”£
£Ø4£©![]() +
+![]() =1ӣ
=1ӣ
“š°ø£ŗ£Ø1£©A B
£Ø2£©2.4
£Ø3£©3”Ć1
£Ø4£©![]() +
+![]() =1
=1


 Źī¼Ł×÷ŅµŹī¼ŁæģĄÖĮ·Ī÷°²³ö°ęÉēĻµĮŠ“š°ø
Źī¼Ł×÷ŅµŹī¼ŁæģĄÖĮ·Ī÷°²³ö°ęÉēĻµĮŠ“š°ø ŠĀ»īĮ¦×ܶÆŌ±ŹīĻµĮŠ“š°ø
ŠĀ»īĮ¦×ܶÆŌ±ŹīĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ101ĶųŠ£Ķ¬²½Į·Ļ°””ø߶ž»Æѧ””ɽ¶«æĘѧ¼¼Źõ³ö°ęÉē Ā³½Ģ°ę ĢāŠĶ£ŗ022
ŌŚ830 KŹ±£¬ĻĀĮŠ·“Ó¦µÄĘ½ŗāĢåĻµ¾ßӊijŠ©ĢŲŹāŠŌ£ŗ
CO(g)£«H2O(g)![]() CO2(g)£«H2(g)
CO2(g)£«H2(g)
¢ŁČōĘšŹ¼ÅØ¶Č·Ö±šĪŖc(CO)£½3 mol”¤L£1£¬c(H2O)£½0.75 mol”¤L£1£¬“ļµ½Ę½ŗāŗóCOµÄ×Ŗ»ÆĀŹĪŖ20£„
¢ŚČōĘšŹ¼ÅØ¶Č·Ö±šĪŖc(CO)£½3 mol”¤L£1£¬c(H2O)£½4.5 mol”¤L£1£¬“ļµ½Ę½ŗāŗóCOµÄ×Ŗ»ÆĀŹĪŖ60£„
Éč830 KŹ±£¬ŅŌĘšŹ¼ÅØ¶Č·Ö±šŅŌc(CO)£½3a mol”¤L£1£¬c(H2O)£½b mol”¤L£1Ķ¶ĮĻ£¬·¢ÉśŅŌÉĻ·“Ó¦£¬²āµĆĘ½ŗāŗóc(H2)£½c mol”¤L£1£®
Ēė×¢ŅāÉĻŹöŹż¾Ż£¬×ܽį³öĘäÖŠ¹ęĀÉ£¬ĢīŠ“ŅŌĻĀæÕ°×£®
(1)Ń”ŌńĢīæÕ£ŗŌŚ¶ą“ĪŹŌŃéÖŠ£¬Čō±£³Öb²»±ä¶ų¼õŠ”a£¬Ōņ“ļµ½Ę½ŗāŹ±COµÄ×Ŗ»ÆĀŹ________Ė®ÕōĘųµÄ×Ŗ»ÆĀŹ________£®
A£®Ōö“ó””””B£®¼õŠ”””””C£®²»±ä””””D£®ĪŽ·ØČ·¶Ø
(2)µ±a£½4£¬c£½1.5Ź±£¬b£½_____________£®
(3)µ±a£½2bŹ±£¬a”Ćc£½_________________£®
(4)a”¢b”¢cŌŚøĆĘ½ŗāÖŠµÄ¹ŲĻµŹ½ŹĒ________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĢīŠ“ŅŌĻĀæÕ°×£ŗ
Éč830 KŹ±£¬ĘšŹ¼ÅضČc(CO)=a mol”¤L-1”¢c(H2O)=b mol”¤L-1£¬
·“Ó¦“ļµ½Ę½ŗāŹ±c(H2)ĪŖc mol”¤L-1”£
£Ø1£©µ±b²»±ä”¢a¼õŠ”£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹ________£¬H2OµÄ×Ŗ»ÆĀŹ________£ØĢī”°Éżøß”±”°½µµĶ”±”°²»±ä”±£©£»
£Ø2£©µ±a=4£¬c=1.5Ź±£¬b=________;
(3)µ±a=bŹ±£¬![]() =________;
=________;
(4)ÓĆŅŌ±ķŹ¾a”¢b”¢cÖ®¼ä¹ŲĻµµÄ“śŹżŹ½ŹĒ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£Ø6·Ö£©ŌŚĪĀ¶ČĪŖ830”ćKŹ±£¬ĻĀĮŠæÉÄę·“Ó¦¾ßӊijŠ©ĢŲŹāŠŌÖŹ£ŗCO+H2O![]() H2+CO2ČōĘšŹ¼ÅضČ[CO]ĪŖ2mol/L”¢[H2O]= 3mol/L£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹĪŖ60%£»Čē¹ū½«H2OµÄĘšŹ¼ÅØ¶Č¼Ó“óµ½6mol/L£¬ŌņCOµÄ×Ŗ»ÆĀŹĪŖ75%”£Ēė×¢ŅāÉĻŹöÓŠ¹ŲŹż¾Ż£¬²¢×ܽį³ö¹ęĀÉ£¬Ķź³ÉĻĀĮŠĪŹĢā£ŗ
H2+CO2ČōĘšŹ¼ÅضČ[CO]ĪŖ2mol/L”¢[H2O]= 3mol/L£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹĪŖ60%£»Čē¹ū½«H2OµÄĘšŹ¼ÅØ¶Č¼Ó“óµ½6mol/L£¬ŌņCOµÄ×Ŗ»ÆĀŹĪŖ75%”£Ēė×¢ŅāÉĻŹöÓŠ¹ŲŹż¾Ż£¬²¢×ܽį³ö¹ęĀÉ£¬Ķź³ÉĻĀĮŠĪŹĢā£ŗ
Éč830”ćKŹ±£¬ĘšŹ¼ÅضČc(CO)ĪŖamol/L”¢c(H2O)ĪŖbmol/L£¬·“Ó¦“ļµ½Ę½ŗāŹ±c(H2)ĪŖcmol/L”£
£Ø1£©µ±b²»±äŹ±£¬a¼õÉŁ£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹ £¬H2OµÄ×Ŗ»ÆĀŹ £ØĢī”°ÉĻÉż”±”¢”°ĻĀ½µ”±»ņ”°²»±ä”±£©
£Ø2£©µ±a=5£¬c=![]() Ź±£¬b=
Ź±£¬b=
£Ø3£©µ±a=bŹ±£¬![]() =
=
£Ø4£©ÓĆŅŌ±ķŹ¾a”¢b”¢cÖ®¼ä¹ŲĻµµÄ“śŹżŹ½ŹĒ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģÕć½Ź”ø߶žĻĀŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
£Ø6·Ö£©ŌŚĪĀ¶ČĪŖ830”ćKŹ±£¬ĻĀĮŠæÉÄę·“Ó¦¾ßӊijŠ©ĢŲŹāŠŌÖŹ£ŗCO+H2O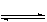 H2+CO2ČōĘšŹ¼ÅضČ[CO]ĪŖ2mol/L”¢[H2O]= 3mol/L£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹĪŖ60%£»Čē¹ū½«H2OµÄĘšŹ¼ÅØ¶Č¼Ó“óµ½6mol/L£¬ŌņCOµÄ×Ŗ»ÆĀŹĪŖ75%”£Ēė×¢ŅāÉĻŹöÓŠ¹ŲŹż¾Ż£¬²¢×ܽį³ö¹ęĀÉ£¬Ķź³ÉĻĀĮŠĪŹĢā£ŗ
H2+CO2ČōĘšŹ¼ÅضČ[CO]ĪŖ2mol/L”¢[H2O]= 3mol/L£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹĪŖ60%£»Čē¹ū½«H2OµÄĘšŹ¼ÅØ¶Č¼Ó“óµ½6mol/L£¬ŌņCOµÄ×Ŗ»ÆĀŹĪŖ75%”£Ēė×¢ŅāÉĻŹöÓŠ¹ŲŹż¾Ż£¬²¢×ܽį³ö¹ęĀÉ£¬Ķź³ÉĻĀĮŠĪŹĢā£ŗ
Éč830”ćKŹ±£¬ĘšŹ¼ÅضČc(CO)ĪŖamol/L”¢c(H2O)ĪŖbmol/L£¬·“Ó¦“ļµ½Ę½ŗāŹ±c(H2)ĪŖcmol/L”£
£Ø1£©µ±b²»±äŹ±£¬a¼õÉŁ£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹ £¬H2OµÄ×Ŗ»ÆĀŹ £ØĢī”°ÉĻÉż”±”¢”°ĻĀ½µ”±»ņ”°²»±ä”±£©
£Ø2£©µ±a=5£¬c=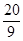 Ź±£¬b=
Ź±£¬b=
£Ø3£©µ±a=bŹ±£¬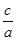 =
=
£Ø4£©ÓĆŅŌ±ķŹ¾a”¢b”¢cÖ®¼ä¹ŲĻµµÄ“śŹżŹ½ŹĒ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com