
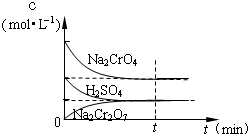
 在25℃时,向Na2CrO4溶液中滴加稀硫酸,溶液由黄色转变为橙色,在此转化过程中,各物质浓度变化如图所示.写出转化过程中发生反应的离子方程式
在25℃时,向Na2CrO4溶液中滴加稀硫酸,溶液由黄色转变为橙色,在此转化过程中,各物质浓度变化如图所示.写出转化过程中发生反应的离子方程式 Cr2O72-+H2O;滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
Cr2O72-+H2O;滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉; Cr2O72-+H2O;加入最后一滴AgNO3溶液出现砖红色沉淀;
Cr2O72-+H2O;加入最后一滴AgNO3溶液出现砖红色沉淀;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题: 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com