
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是 ( )
A.Na+、Ba2+、NO 、CO
、CO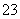
B.Ba2+、K+、Cl-、NO
C.Mg2+、NH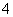 、SO
、SO 、Cl-
、Cl-
D.Fe2+、Na+、SO 、NO
、NO
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.( NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知电离平衡常数:H2CO3>HClO>HCO ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 ( )
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 ( )
A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl-
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO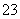
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是 ( )。
A.碳酸钠的水解:CO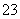 +2H2O
+2H2O H2CO3+2OH-
H2CO3+2OH-
B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH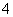
C.用惰性电极电解氯化镁溶液:2Cl-+2H+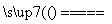 H2↑+Cl2↑
H2↑+Cl2↑
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L二氯甲烷的分子数约为NA个
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
C.17.6 g丙烷中所含的极性共价键为4NA个
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH 溶液中,由水电离的OH-离子数目为0.1NA
溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3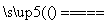 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,22.4 L NH3中含有3NA个N—H键
B.1 mol·L-1 CaCl2溶液含有NA个Ca2+
C.48 g O3和O2的混合气体中含有3NA个O原子
D.1 mol NO2溶于水后溶液中含有NA个NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com