
| A. | 该溶液的pH约是4 | |
| B. | HA一定是一种弱酸 | |
| C. | 恰好中和时消耗NaOH的物质的量是10-6mol | |
| D. | 与足量Mg完全反应生成标准状况下气体的体积可能是11.2 mL |
分析 A.c(H+)=0.1mol•L-1×0.1%=10-4mol/L,根据pH=-lgc(H+)计算;
B.由于HA在溶液中部分电离,则HA为弱酸;
C.HA与NaOH的物质的量相等时二者恰好中和;
D.根据H原子守恒计算出生成氢气的物质的量,然后根据V=nVm计算出生成氢气的体积.
解答 解:A.c(H+)=0.1mol•L-1×0.1%=10-4mol/L,则该溶液的pH=-lg10-4=4,故A正确;
B.一元酸HA在水中约有0.1%发生电离,说明HA为弱酸,存在电离平衡,故B正确;
C.10mL 0.1mol•L-1的一元酸HA溶液中含有HA的物质的量为;0.1mol/L×0.01L=0.001mol,则恰好中和时消耗NaOH的物质的量为0.001mol,故C错误;
D.根据H原子守恒可知0.001molHA与足量Mg完全反应生成氢气的物质的量为:0.001mol×$\frac{1}{2}$=0.0005mol,标准状况下0.0005mol氢气的体积约为:22.4L/mol×0.0005mol=0.0112L=11.2mL,故D正确;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,注意掌握弱电解质的电离特点及其影响因素,明确中和反应实质,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
有关反应原理说法错误的是
A.碳酸钙与盐酸反应过程中,再增加CaCO3固体的量,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率
B.增大反应体系的压强,反应速率不一定增大
C.由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大
D.对于2SO2(g)+O2(g)  2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志
2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发结晶的方法分离碳酸钠和水 | |
| B. | 用过滤的方法分离植物油和水 | |
| C. | 用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点118℃) | |
| D. | 用萃取和分液的方法用CCl4从碘水提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 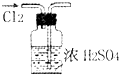 干燥Cl2 | B. | 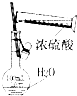 配制100ml 0.1mol•L-1硫酸溶液 | ||
| C. | 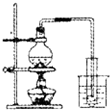 制取少量蒸馏水 | D. | 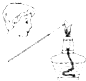 检验钾元素的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
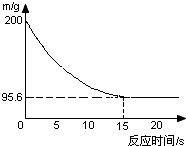 化学实验室有一瓶Na2CO3和NaCl固体混合物粉末,现小张同学取该固体粉末14.9g于烧杯中,并向烧杯中加入149.5g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示:烧杯连同药品的起始质量为200g.
化学实验室有一瓶Na2CO3和NaCl固体混合物粉末,现小张同学取该固体粉末14.9g于烧杯中,并向烧杯中加入149.5g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示:烧杯连同药品的起始质量为200g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL0.3 mol•L-1Na2CO3 | B. | 10mL0.4 mol•L-1Na2CO3 | ||
| C. | 25mL0.4 mol•L-1Na2CO3 | D. | 15mL0.5 mol•L-1Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2,乙烷的结构简式为CH3CH3 | |
| B. | 互为同系物的两种化合物具有相同的最简式,且化学性质相似 | |
| C. | 苯和乙烯都可以与溴水、高锰酸钾溶液反应而使它们褪色 | |
| D. | 乙烯分子中所有原子处于同一平面上,乙烷分子为立体结构,原子不都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法错误的是( )
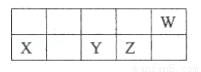
A. 原子半径由大到小的顺序:X、Y、Z、W
B. 元素最高正价由低到高的顺序:X、Y、Z、W
C. 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W
D. 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com