
| A. | 丙烯加聚 | B. | 丙烯与水加成 | C. | 丙烯与Br2加成 | D. | 丙烷与Br2光取代 |
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 苯酚钠溶液中通入少量CO2: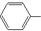 O-+CO2+H2O→ O-+CO2+H2O→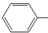 OH+HCO3- OH+HCO3- | |
| C. | NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++2HCO3-+2OH-═CaCO3↓+H2O+CO32- | |
| D. | BaCO3固体中加入足量稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
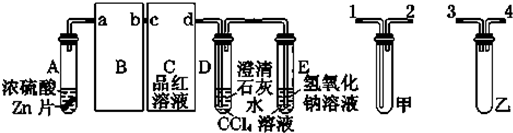
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法正确的是( )
苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法正确的是( )| A. | 属于芳香族化合物,分子式为C18H16N2O | |
| B. | 分子中的所有原子一定位于同一平面上 | |
| C. | 分子中苯环上的一取代物共有12种 | |
| D. | 可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | 含W的盐溶液一定呈酸性 | |
| C. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | W和Y形成的原子个数比为1:1的共价化合物,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域,是一种原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
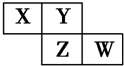 15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | Z、W的气态氢化物还原性:W>Z | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com