


| 150×72% |
| 12 |
| 150×6.67% |
| 1 |
| 150-10-12×9 |
| 16 |


科目:高中化学 来源: 题型:
 Cu、Zn、稀H2SO4形成如图甲乙装置.
Cu、Zn、稀H2SO4形成如图甲乙装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
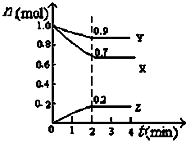 含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、SO3、Na2SO3、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、SO3、Na2SO3、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol苯乙烯都能与4moH2发生加成反应,说明其分子内含有4个碳碳双键 |
| B、蔗糖在人体内水解的产物只有葡萄糖 |
| C、食醋中含有乙酸,乙酸可由乙醇氧化得到 |
| D、温度越高,酶对某些化学反应的催化效率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、 的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)有四种 的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)有四种 |
| B、C7H16的所有同分异构体中,分子中含有四个甲基的有五种 |
| C、某有机物的化学式为C4H8O3,现有0.1 mol该有机物分别与足量的钠、足量的碳酸氢钠溶液反应,生成标准状况下的气体分别为2.24 L H2、2.24 L CO2.则该有机物的同分异构体(不考虑立体异构) 共3种 |
| D、分子式为C4H10O并能发生酯化反应的有机物同分异构体有X种(不包括立体异构,下同),分了式为C5H10O并能发生银镜反应的有机物的同分异构体有y种,x>y |
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
3 1 |
23 12 |
24 12 |
65 29 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com