
 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1 CH3OH(g) △H2
CH3OH(g) △H2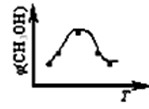
| A.升高温度 | B.增加CO2的量 |
| C.充入He,使体系总压强增大 | D.按原比例再充入CO2和H2 |
 CH3OH(g)
CH3OH(g)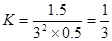 。
。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.0.8 | B.1.3 | C.1.6 | D.3.1? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α, 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
| C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 |
 CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。 CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH=-90.8 kJ·mol-1K1
CH3OH(g) ΔH=-90.8 kJ·mol-1K1 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1K2
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1K2 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1K3
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1K3 CH3OCH3(g) +CO2 (g)的ΔH= _____ , K= (用包含K1、 K2、 K3的式子表示).一定条件下的等容密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g) +CO2 (g)的ΔH= _____ , K= (用包含K1、 K2、 K3的式子表示).一定条件下的等容密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.488.3 | B.-244.15 | C.244.15 | D.-488.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2C8H18 + 25O2 = 16CO2 + 18H2O△H =-11036 kJ·mol-1 |
| B.2C8H18(l) + 25O2(g) = 16CO2(g) + 18H2O(l)△H =-11036 kJ·mol-1 |
| C.2C8H18(l) + 25O2(g) = 16CO2(g) + 18H2O(g)△H =-11036 kJ·mol-1 |
| D.2C8H18(l) + 25O2(g) = 16CO2(g))+18H2O(l)△H =-5518kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/KJ.mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
 Si(s)+4HCl(g),计算该反应的反应热△H为 。
Si(s)+4HCl(g),计算该反应的反应热△H为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 全部由碳燃烧提供,问理论上要消耗多少克碳?
全部由碳燃烧提供,问理论上要消耗多少克碳?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com