
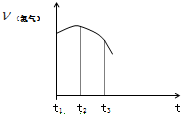
 把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是

科目:高中化学 来源: 题型:
| A、大理石和稀硫酸制取二氧化碳 |
| B、锌粒和稀硫酸制氢气 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、过氧化钠和水制取氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
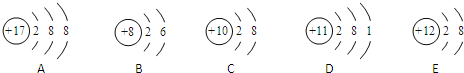
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类是具有甜味的物质 |
| B、糖类是具有Cn(H2O)m通式的物质 |
| C、葡萄糖是一种单糖的主要原因是一种多羟基醛 |
| D、淀粉是一种白色粉末,本身没有甜味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
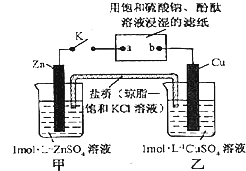
| A、片刻后可观察到滤纸b点变红色 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后甲池中c(SO42-)增大 |
| D、Cu电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
| B、氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
| C、氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
| D、最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com