
| A. | ①>②>③>④ | B. | ④>①>②>③ | C. | ②>①=③>④ | D. | ①>②=③>④ |
分析 氢氧化钠分别下列各物质的反应方程式为:①2Al+2NaOH+2H2O=2NaAlO2+3H2↑;②Al2O3+2NaOH=2NaAlO2+H2O; ③Al(OH)3+NaOH=NaAlO2+2H2O; ④AlCl3+3NaOH=Al(OH)3+3NaCl,由此分析解答.
解答 解:氢氧化钠分别下列各物质的反应方程式为:①2Al+2NaOH+2H2O=2NaAlO2+3H2↑,0.5mol的铝与0.5mol的氢氧化钠恰好完全反应生成0.5mol的偏铝酸根离子,而反应中消耗溶剂水,所以溶剂的体积减少,浓度变大;
②Al2O3+2NaOH=2NaAlO2+H2O
1mol 2mol
0.5mol 0.5mol
所以氧化铝过量,生成0.5mol的偏铝酸根离子,同量产生0.25mol的水,而反应中生成溶剂水,体积增大,所以浓度变小;
③Al(OH)3+NaOH=NaAlO2+2H2O,两者恰好完全反应,生成0.5mol的偏铝酸根离子,同时产生1mol的水,所以阴离子的浓度比②小;
④AlCl3+3NaOH=Al(OH)3+3NaCl,
1mol 3mol
0.5mol 0.5mol,所以氯化铝过量,最终得氯化钠和氯化铝的混合溶液,所以阴离子的物质的量为1.5mol,所以所得溶液中阴离子浓度的大小顺序是④>①>②>③,故选B.
点评 本题考查根据方程式的计算,比较基础,清楚反应过程溶剂的量变化和过量问题的判断是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物稳定性按X、Y、Z依次减弱 | |
| C. | 非金属性:X>Y>Z | |
| D. | 阴离子还原性:X-<Y2-<Z3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

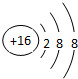 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
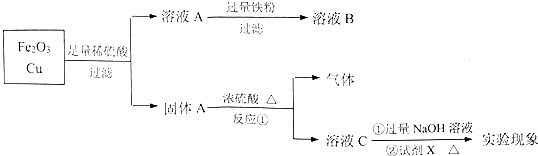
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
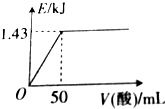 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )| A. | 0.5mol•L-1 | B. | 0.4mol•L-1 | C. | 0.25mol•L-1 | D. | 0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③④ | C. | ②④⑤ | D. | 全部正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com