
分析 (1)根据m=nM计算0.5molH2SO4的质量;每个H2SO4分子含有4个氧原子,则n(O)=4n(H2SO4 ),再根据N=nNA计算氧原子数目;硫酸与NaOH按物质的量之比1:2反应,据此计算NaOH的物质的量;每个H2SO4分子含有2个H原子,则n(H)=2n(H2SO4 ),含有氢元素质量相等,则H原子物质的量相等,计算n(H3PO4)、n(HCl),再根据V=nVm计算HCl的体积;
(2)利用n=$\frac{m}{M}$计算出它们的物质的量,物质的量之比等于分子数目之比,再利用分子的构成来计算所含O的物质的量之比;
(3)根据分子式与氯离子间的关系计算RCl3的物质的量,再根据物质的量、质量、摩尔质量之间的关系式计算其摩尔质量;
(4)由关系式:2Na~H2,2Mg~2H2,2Al~3H2,根据关系式进行计算.
解答 解:(1)0.5mol H2SO4 的质量=0.5mol×98g/mol=49g;
每个H2SO4分子含有4个氧原子,则n(O)=4n(H2SO4 )=4×0.5mol=2mol,故氧原子数目为2NA;
硫酸与NaOH按物质的量之比1:2反应,消耗NaOH的物质的量=2×0.5mol=1mol;
每个H2SO4分子含有2个H原子,则n(H)=2n(H2SO4 )=2×0.5mol=1mol,含有氢元素质量相等,则H原子物质的量相等,则n(H3PO4)=$\frac{1}{3}$×1mol=$\frac{1}{3}$mol,n(HCl)=1mol,V(HCl)=1mol×22.4L/mol=22.4L,故答案为:49、2NA、1、$\frac{1}{3}$、22.4;
(2)设SO2和SO3的质量都是80g,
则n(SO2)=$\frac{80g}{64g/mol}$=$\frac{5}{4}$mol,
n(SO3)=$\frac{80g}{80g/mol}$=1mol,
则所含物质的量之比为$\frac{5}{4}$mol:1mol=5:4,
所含氧原子的个数之比为$\frac{5}{4}$mol×2:1mol×3=5:6,
故答案为:5:4;5:6;
(3)金属氯化物(RCl3)中含有0.6mol Cl-,所以金属氯化物的物质的量为0.2mol,所以M=$\frac{26.7g}{0.2mol}$=133.5 g•mol-1;R的相对原子质量是133.5-35.5×3=27;相对原子量为27的是铝,所以化学式为:AlCl3;故答案为:133.5 g•mol-1;27;AlCl3;
(4)因等物质的量的Na、Mg、Al与足量的盐酸反应生成的H2,由关系式:2Na~H2,2Mg~2H2,2Al~3H2,产生H2的质量之比为:1:2:3,
故答案为:1:2:3.
点评 本题考查的是物质的量浓度的有关计算,侧重考查学生对各物理量关系的掌握程度.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①不变、②不变、③增大、④增大 | B. | ①不变、②不变、③增大、④不变 | ||
| C. | ①减小、②不变、③增大、④不变 | D. | ①减小、②不变、③增大、④增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
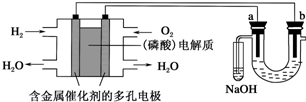
| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH- | |
| B. | 电解时,a电极周围首先放电的是Cl-,而不是Br- | |
| C. | 电解时,电子流动路径是:负极-→外电路-→阴极-→溶液-→阳极-→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.02 g H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com