
【题目】我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )

A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol H2O解离
【答案】C
【解析】
根据图示可知,放电时是原电池,放电时,负极为锌,锌在负极失去电子生成锌离子,结合复合膜层电离出的氢氧根离子生成Zn(OH)42-,负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-,多孔Pd纳米片为正极,二氧化碳在正极得到电子转化为甲酸,电极反应为CO2+2H++2e-=HCOOH, 总的电极反应为:Zn+2OH-+2H2O+CO2= Zn(OH)42-+HCOOH,充电时的电极反应与放电时的反应相反,由此分析。
A.由图可知,a膜释放出氢离子,是阳离子膜,b膜释放出氢氧根离子,是阴离子膜,故A正确;
B.根据图示可知,放电时是原电池,负极为锌,锌在负极失去电子生成锌离子,结合复合膜层电离出的氢氧根离子生成Zn(OH)42-,负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-,故B正确;
C.放电时多孔Pd纳米片为正极,二氧化碳在正极得到电子转化为甲酸,充电时是电解池,甲酸在多孔Pd纳米片表面转化为CO2,故C错误;
D.复合膜层间的H2O解离成H+和OH-,根据总的电极反应:Zn+2OH-+2H2O+CO2= Zn(OH)42-+HCOOH,锌的化合价从0价升高到+2价,外电路中每通过1mol电子,复合膜层间有1mol H2O解离,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
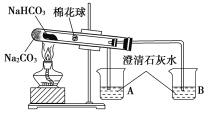
(小试管内塞有沾有无水硫酸铜粉末的棉花球)
(1)从点燃酒精灯开始,试管及烧杯B中能观察到的现象有____________________。
(2)通过该实验可得出的结论是_________________________________。
(3)本装置的优点是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】囧烷(G)是一种重要的烃,一种合成囧烷的路线如图所示:
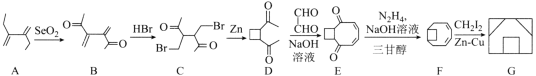
已知: +R2—CHO
+R2—CHO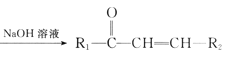 +H2O。
+H2O。
请回答下列问题:
(1)A的化学名称为___;G的分子式为__。
(2)B→C的反应类型为___;C中所含官能团的名称为__。
(3)D→E的化学方程式为___。
(4)同时满足下列条件的B的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为___。
①属于芳香族化合物且苯环上连有3个取代基。
②与FeC13溶液发生显色反应。
(5)参照上述合成路线和信息,以![]() 为原料(其他试剂任选),设计制备
为原料(其他试剂任选),设计制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:
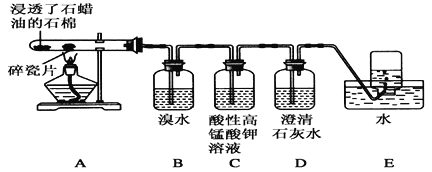
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为________,乙的结构简式为____________________________________。
4乙,则甲的分子式为________,乙的结构简式为____________________________________。
(2)B装置中的实验现象可能是________,写出反应的化学方程式:__________,其反应类型是________。
(3)C装置中可观察到的现象是____________,反应类型是________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_____(填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由: __________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是________。
A.气体通入水中 B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,甲烷火焰明亮而乙烯产生少量黑烟,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.1molK2Cr2O7被还原为Cr3+转移的电子数为3NA
B.0.1molCH4与Cl2在光照下反应生成的CH3Cl分子数为0.1NA
C.0.1molFeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒
D.乙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )

A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
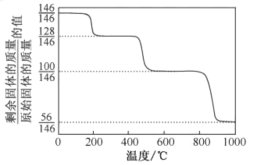
①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
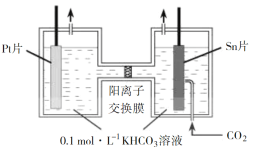
①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,弱酸H2A溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ[δ(X)=![]() ]随溶液pH变化的关系如图所示,下列说法错误的是
]随溶液pH变化的关系如图所示,下列说法错误的是
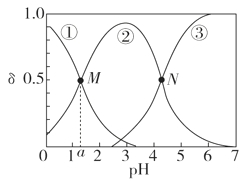
A.pH>4的溶液中,δ(A2-)= ,
,
B.M点对应的溶液中水的电离程度小于N点
C.若图中a为1.2,则lg [Ka1(H2A)]=-1.2
D.曲线②代表的粒子是HA-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com