
【题目】人胃酸(主要成分是盐酸)过多,会引起很多胃病。下图为某抗酸药包装标签上的部分文字,请回答下列问题。

(1)该药“嚼碎后吞服”的原因是_____________________。
(2)某同学为测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0mL。通过计算:
①判断该药片中氢氧化铝的含量是否与标签相符;
②确定该药片中氢氧化铝的质量分数为多少。
【答案】(1)增大接触面积,使反应更充分。(意思相同均给分)1分
(2)①故该药片中氢氧化铝的含量没有达到标注,②该药片中氢氧化铝的质量分数为43.6%。
【解析】
试题分析:(1)某抗酸药主要成分是难溶性的氢氧化铝固体,嚼碎可以使其余胃酸的接触面积增大,使反应速率加快,更好的发挥作用,治疗胃病;(2)①氢氧化铝与盐酸会发生反应:Al(OH)3+3HCl=AlCl3+3H2O,盐酸中HCl的质量是m(HCl)= 1.02g/mL×6.0mL×5%=0.306g,根据方程式可知:m[Al(OH)3]:m(HCl)=78:109.5,则0.306gHCl完全反应,需要的氢氧化铝的质量是m[Al(OH)3]= (78÷109.5)×0.306g=0.2179g=218mg<250mg,所以该药片中氢氧化铝的含量与标签不相符;②该药片中氢氧化铝的质量分数为(0.218g÷0.5g)×100%=43.6%。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。下列关于碳纳米管的说法不正确的是
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
⑴Ga的原子结构示意图为 ___________________。
⑵GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式 。
⑶下列有关镓和镓的化合物的说法正确的是____ 。
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
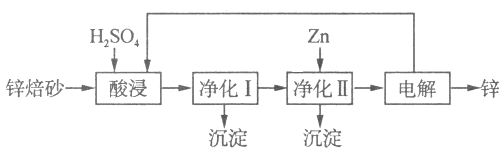
已知:Fe的活泼性强于Ni
⑷ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为 。
⑸净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
⑹净化II中加入Zn的目的是___________________。
⑺常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0 × 10-38;lg5 = 0.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是( )
A.水、双氧水、水玻璃都是纯净物
B.石墨和C60互称为同位素
C.磷酸钙是可溶性强电解质
D.一定条件下石墨转化为C60是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+![]() O2(g)===H2O(g),反应过程中能量变化如下图,问:
O2(g)===H2O(g),反应过程中能量变化如下图,问:
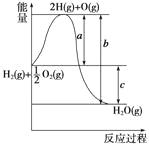
(1)a、b、c分别代表什么意义?
a______________;b____________;c__________。
(2)该反应是放热反应还是吸热反应?__________。ΔH大于零还是小于零?________
(3)若已知2H2(g)+O2(g)===2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)===2H2O(l) ΔH2=-Q2
则ΔH1______ΔH2,Q1______Q2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如下。

(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 。
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 。
(3)“赶氨”时,最适宜的操作方法是 。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
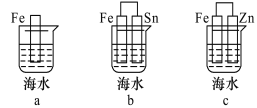
【题目】(1)下列各情况中, Fe片被腐蚀的速率由快到慢的顺序是 (填字母)。
(2)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2 = 2H2O,完成下列问题:
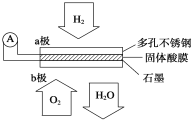
① 电子通过外电路从 极流向 极(填a或b)。
② b极上的电极反应式为: 。
③ 每转移0.1 mol电子,消耗H2的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平。回答下列问题:
(1)乙烯的电子式为 ,结构简式为 。
(2)下列可以鉴别甲烷和乙烯的试剂为 (填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是 (填选项字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)已知2CH3CHO+O2![]() 2CH3COOH,以乙烯为主要原料合成乙酸,合成线路如下图所示:
2CH3COOH,以乙烯为主要原料合成乙酸,合成线路如下图所示:
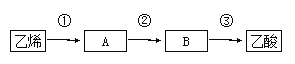
反应③的反应类型为 反应,反应②的化学方程式为 。
(5)工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,该反应类型为 反应,其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用醋中含有乙酸。下列关于乙酸的说法正确的是( )
A. 结构简式为:C2H4O2 B. 分子式为:CH3COOH
C. 可与金属Na反应生成H2 D. 分子中原子之间只存在单键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com