
 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
分析 (1)弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,醋酸分子物质的量减小,浓度减小,酸性减弱,水的离子积常数不变,醋酸的电离平衡常数不变;
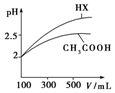
(3)据图分析,加水稀释的过程中,HX的pH变化比较快,说明HX的酸性比醋酸强;
(4)图表中数据分析可知,酸性强弱:CH3COOH>H2CO3>HClO>>HCO3-,84消毒液(主要成分NaClO)在空气中变质是次氯酸钠吸收空气中二氧化碳反应生成碳酸氢钠和次氯酸,次氯酸见光分解生成盐酸和氧气;
解答 解:(1)据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3-,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱,
A、氢离子浓度减小,故A错误;
B、加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故B正确;
C、水的离子积常数不变,故C错误;
D、醋酸溶液加水稀释时酸性减弱,氢离子浓度减小氢氧根离子浓度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故D正确;
E、醋酸的电离平衡常数不变,故E错误;
故答案为:BD;
(3)据图分析,加水稀释的过程中,HX的pH变化比较快,说明HX的酸性比醋酸强,HX的电离平衡常数比醋酸大,
故答案为:大于;加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)酸性强弱:CH3COOH>H2CO3>HClO>>HCO3-,84消毒液(主要成分NaClO)在空气中变质是次氯酸钠吸收空气中二氧化碳反应生成碳酸氢钠和次氯酸,次氯酸见光分解生成盐酸和氧气,反应的离子方程式为:CO2+ClO-+H2O═HClO+HCO3- 2HClO═2H++2Cl-+O2↑,
故答案为:CO2+ClO-+H2O═HClO+HCO3- 2HClO═2H++2Cl-+O2↑.
点评 本题考查弱电解质的电离,根据平衡常数确定酸性强弱,从而确定水解程度,注意加水稀释时从各微粒的物质的量变化分析,题目难度中等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
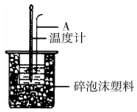 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com