
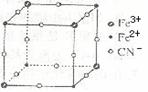
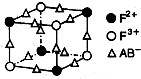
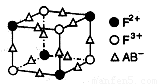
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+ 和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如右图所示。下列说法正确的是( )
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,M呈+2价
D.晶体中与每个Fe3+距离最近且等距离的CN-为3个
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:阅读理解
| 元素 | 性质或结构信息 |
| X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. |
| Y | 二价阳离子的外围电子层排布为3d9 |
| T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 |
| Q | 第三周期主族元素中原子半径最小 |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

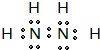
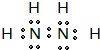
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学--选修3物质结构与性质】
【化学--选修3物质结构与性质】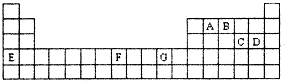
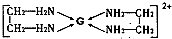 该配离子中含有的化学键类型有
该配离子中含有的化学键类型有| 1 | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质或结构信息 | X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | Y | 二价阳离子的外围电子层排列为3d9 | T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂. | Q | 第三周期主族元素中原子半径最小. |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省宝鸡市高三第三次模拟理综化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,其中A—G分别代表一种元素。
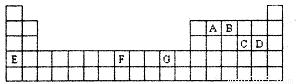
请根据表中所列元素,回答下列问题:
(1)所列元素中第一电离能最小的是 (填元素符号);D元素原子核外有 种不同运动状态的电子;基态原子的价电子层中,未成对电子数最多的元素是 (填元素符号)。
(2)AC2分子的空间构型是 ,该分子中A原子的杂化方式为 。
(3)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物的溶解度,原因是 。
(4)基态G2+的核外电子排布式是
,乙二胺(结构简式为H2N—CH2一CH2—NH2)分子中的碳原子的杂化方式为 ,G2+与乙二胺可形成配离子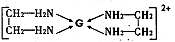 该配离子中含有的化学键类型有 (填字母编号)。
该配离子中含有的化学键类型有 (填字母编号)。
a.配位键 b.极性键 c.离子键 d.非极性键
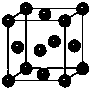
(5)化合物EF[F(AB)6]是一种常见的蓝笆晶体,其中的AB—与B2为等电子体,则、AB—的电子式为
。下图为该蓝色晶体晶胞的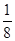 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com