
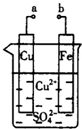
| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu |
| C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D、a和b连接时,铁片质量增加 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2gH2所占有的体积是22.4L |
| B、11.2LO2的质量是16g |
| C、标准状况下,22.4LH2O含有6.02×1023个H2O分子 |
| D、常温下压下32gO2与标准状况下22.4LN2含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:10:100:1 |
| B、1:10-1:10-12:10-14 |
| C、14:13:12:14 |
| D、14:13:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过量氨水除去Al3+溶液中的少量Fe3+ |
| B、将混合气体通过灼热的铜网除去N2中的少量O2 |
| C、用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 |
| D、用CO2除去NaHCO3溶液中少量的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列物质的溶液在空气中长期放置,其pH的变化与图示相符的是( )
下列物质的溶液在空气中长期放置,其pH的变化与图示相符的是( )| A、①②④ | B、②③⑤ |
| C、②③ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中含有1mol K2SO4 |
| B、1molK2SO4溶于1L水中 |
| C、可与1L 1mol/L BaCl2溶液完全反应 |
| D、1L溶液中含2molK+、1molSO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com