
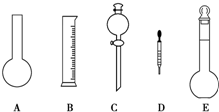
 碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、胶体粒子直径在1nm-100nm之间 |
| B、胶体可发生丁达尔效应 |
| C、胶体粒子不能透过半透膜 |
| D、胶体粒子能够发生布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
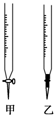 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.03 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.60 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
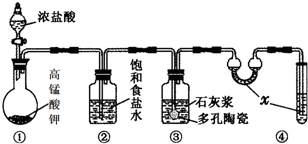 实验室常用以下几种方法制取氯气
实验室常用以下几种方法制取氯气查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
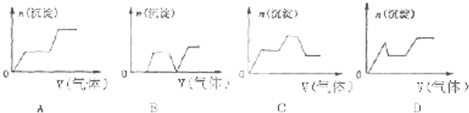
| t/min | 0 | 5 | 10 |
| AO/mol?L-1 | 1.00 | 0.65 | 0.50 |
| H2/mol?L-1 | 2.00 | 1.00 | |
| AH3OH/mol?L-1 | 0.00 | 0.35 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
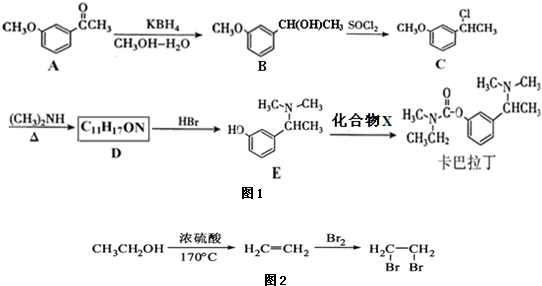
 )和丙酮(
)和丙酮( )制备化合物
)制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图如图2:
的合成路线流程图(无机试剂任选).合成路线流程图如图2:查看答案和解析>>
科目:高中化学 来源: 题型:
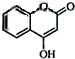 是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成: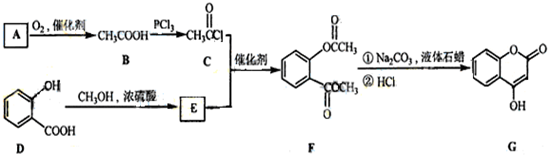
查看答案和解析>>
科目:高中化学 来源: 题型:
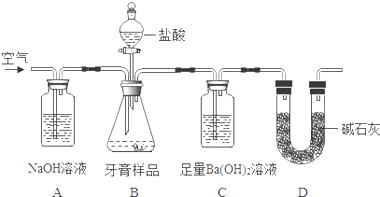
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com