
| A. | 84% | B. | 60% | C. | 91% | D. | 无法计算 |
分析 乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,进一步看作CH、H2O的混合物,根据O元素的分数计算H2O的质量分数,进而计算CH的质量分数,再根据CH中C、H质量之比为12:1,据此计算C元素的质量分数.
解答 解:乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,进一步看作CH、H2O的混合物,O元素的分数为8%,故H2O的质量分数为$\frac{8%}{\frac{16}{18}}$=9%,故CH的质量分数1-9%=91%,CH中C、H质量之比为12:1,故C元素的质量分数为91%×$\frac{12}{13}$=84%,故选A.
点评 本题考查混合物中元素质量分数的计算,难度中等,关键是根据物质的化学式转化为CH与水的混合物.


科目:高中化学 来源: 题型:解答题
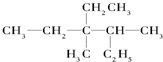 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷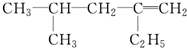
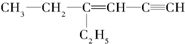 ,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个
,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个查看答案和解析>>
科目:高中化学 来源: 题型:解答题
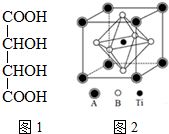 钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.
钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
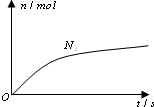 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )| A. | ②④⑥⑦⑧ | B. | ⑤④③①⑧ | C. | ①⑤④③⑧ | D. | ②①⑤③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 113号元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑥ | C. | ③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com