
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.用木炭作燃料 | B.用液氢替代汽油 |
| C.开发风能 | D.开发地热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑥⑦ | B.①③⑤⑥ | C.⑤⑦ | D.⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.汽水的pH为3~4,它显碱性 |
| B.取少量的汽水,滴入紫色石蕊溶液,溶液变成了蓝色 |
| C.打开汽水盖时,有大量气泡冒出,说明气体的溶解度随压强减小而减小 |
| D.胃酸过多的病人应多喝汽水 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用生物质能就是间接利用太阳能 | B.生物质能是可再生的能源 |
| C.生物质能是解决农村能源的重要途径 | D.生物质能的缺点是严重污染环境 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时NH4Cl溶液的水的离子积常数Kw大于100℃时NaCl溶液的Kw |
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O SO32―+2I―+4H+ SO32―+2I―+4H+ |
| C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2―、NO3- |
| D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
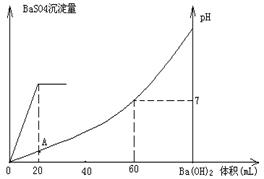
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml | |
 H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com