
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)①由表格数据可知,温度越高,K越小,则升高温度平衡逆向移动;
②2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则
CO(g)+2H2(g)?CH3OH(g)
开始 1 3 0
转化 0.8 1.6 0.8
平衡 0.2 1.4 0.8
转化率=$\frac{转化的量}{开始的量}$×100%、K=$\frac{0.8}{0.2×1.{4}^{2}}$=2.041;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
结合盖斯定律可知,(①-②+③×4)×$\frac{1}{2}$得到CH3OH(l)+O2(g)=CO(g)+2 H2O(l);
(3)由图可知,甲醇在负极上失去电子生成碳酸根离子,氧气在正极上得到电子生成氢氧根离子,电池反应消耗KOH,以此来解答.
解答 解:(1)①由表格数据可知,温度越高,K越小,则升高温度平衡逆向移动,可知正反应为放热反应,则△H1<0,故答案为:<;
②2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则
CO(g)+2H2(g)?CH3OH(g)
开始 1 3 0
转化 0.8 1.6 0.8
平衡 0.2 1.4 0.8
CO的转化率为$\frac{0.8}{1}$×100%=80%,
K=$\frac{0.8}{0.2×1.{4}^{2}}$=2.041,结合表格数据可知温度为250℃,
故答案为:80%;250℃;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
结合盖斯定律可知,(①-②+③×4)×$\frac{1}{2}$得到CH3OH(l)+O2(g)=CO(g)+2 H2O(l),△H=[(-1275.6kJ/mol)-(-566.0kJ/mol)+(-44.0kJ/mol)×4]×$\frac{1}{2}$=-442.8kJ•mol-1,即甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ•mol-1;
(3)①氧气在正极上得到电子生成氢氧根离子,该电池正极的电极反应为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
③工作一段时间后,电池反应消耗KOH,测得溶液的pH 减小,故答案为:减小.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及转化率的计算、盖斯定律应用及原电池为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | 仅②③ | C. | ②③④ | D. | 仅④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
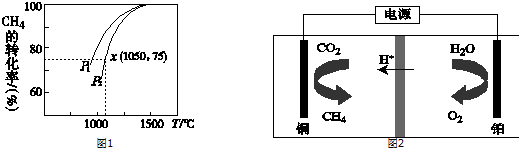
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应②中,反应物的键能大于生成物的键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: | B. | S2-的结构示意图: | ||
| C. | HF的电子式: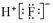 | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com