
����Ŀ����ѧ����ʽ�ܹ���ֱ������ı�ʾ��ѧ��Ӧ�Ĺ�����������һ�ַ��ţ���д��ѧ����ʽ�����DZ������յ�һ��������ܡ��밴��Ҫ��������з���ʽ��
���������кܶ������ԭ���������û�ѧ��Ӧ�����ͣ�
��1��д����ĭ�������Ӧԭ�������ӷ���ʽ�� ��
��2����ClO2��������ˮ������ʹ��Cl2���кܸߵ���Խ�ԣ�����ɱ������Ч�ʸߣ��������°����л��Ȼ�����һ��ܳ�ȥˮ�е�Fe2+��Mn2+����д��ClO2��ȥ����ˮ��Mn2+�����ӷ�Ӧ����ʽ����֪Mn2+ת��ΪMnO2�� ClO2ת��ΪClO2���� ��
����������ϵ�е����ʼ����ʵ����ʣ����ǿ����Ʋ������ϵ�������ı仯�������÷���ʽд�dz�����
��1��ijһ��Ӧ��ϵ�з�Ӧ��������ﹲ�������ʣ�N2O��FeSO4��Fe��NO3��3��HNO3��Fe2��SO4��3��H2O��д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2����NaClO��Һ��ε��뺬���۵�NaI��Һ�У���Һ�����������μӣ���Һ˳ɫ�ȼ������dz��������ʧ��������֪��ʱ��Һ�к���һ�ֺ������Ԫ�صĺ��������д�������仯���̵��������ӷ�Ӧ����ʽ �� ��
��������ѧ��Ӧ������Ϊ�˸��õ��о���Ӧ�Ĺ��������������������ǰ��շ�Ӧ�ı��ʡ��û���Ӧ�dz�����Ӧ����֮һ����ͨʽ���Ա�ʾΪ��������l��ʮ��������l��= ��������2��ʮ������2������д����������Ҫ���2���н������ʲ�����û���Ӧ��ѧ����ʽ�������漰��Ԫ�ض��Ƕ�����Ԫ�أ���4�ֵ��ʷ���4����ͬ�����壺 ��
���𰸡�
I����1��Al3++3HCO3��=Al��OH��3��+3CO2��
��2��2ClO2+Mn2++2H2O=MnO2��+2ClO2��+4H+
II����1��24FeSO4+30HNO3=8Fe��NO3��3+8Fe2��SO4��3+3N2O��+15H2O
��2��H2O+ClO��+2I��=Cl��+I2+2OH��
5ClO��+I2+2OH��=2IO3��+5Cl��+H2O
III��2Al+6HCl��2AlCl3+3H2��
2Mg+CO2![]() 2MgO+C��������Ҳ�ɵ÷�
2MgO+C��������Ҳ�ɵ÷�
��������
���������������1����ĭ�������ԭ��Ϊ��Al2��SO4��3 + 6NaHCO3 = 3Na2SO4 + 2Al��OH��3�� + 6CO2�� ��ʵ�������κ�С�մ��˫ˮ�ⷴӦ����Al3+ + 3HCO3�� = Al��OH��3�� + 3 CO2������2���������֪��ClO2����������Mn2+�ǻ�ԭ������ԭ������ClO2��������������MnO2���ɷ�Ӧ���������ӵ�ʧ�غ㡢����غ��ԭ���غ���ƽ�ɵ���2ClO2+Mn2++2H2O=MnO2��+2ClO2��+4H+��
������1��ϡ�������ǿ�������������ξ��л�ԭ������÷�ӦΪ
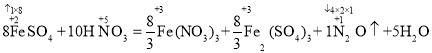 ����������ϵ��������3�ɵ���24 FeSO4 + 30 HNO3 = 8 Fe��NO3��3 + 8 Fe2��SO4��3 + 3 N2O�� + 15 H2O����2���������֪��ClO���Ƚ�I������ΪI2������Һ�����������غ㡢����غ��ԭ���غ���ƽ�ɵ���H2O+ClO��+2I��=Cl��+I2+2OH����
����������ϵ��������3�ɵ���24 FeSO4 + 30 HNO3 = 8 Fe��NO3��3 + 8 Fe2��SO4��3 + 3 N2O�� + 15 H2O����2���������֪��ClO���Ƚ�I������ΪI2������Һ�����������غ㡢����غ��ԭ���غ���ƽ�ɵ���H2O+ClO��+2I��=Cl��+I2+2OH����
����������Ԫ��������������Li��Be��Na��Mg��Al����4�ֵ��ʷ���4����ͬ�������������Ҫ��Ŀ���Ϊ2Al+6HCl��2AlCl3+3H2����2Mg+CO2![]() 2MgO+C��2Na+2H2O��2NaOH+H2���ȵȡ�
2MgO+C��2Na+2H2O��2NaOH+H2���ȵȡ�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������н��з�Ӧ��X2(g)+Y2(g)![]() 2Z(g)����X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��״̬ʱ������˵����ȷ����
2Z(g)����X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��״̬ʱ������˵����ȷ����
A��Z��Ũ�ȿ���Ϊ0.3mol/L
B��ƽ��ʱX2��Y2��ת�������
C��ƽ��ʱ��Y2��Z����������֮��Ϊ2:1
D����ƽ����ٸı���������������¶ȣ���Ӧ��ƽ�ⳣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£������л���Ϊ������ǣ� ��
A. CH4 B. C6H6 C. C2H5OH D. CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��CPAE�Ƿ佺����Ҫ���Գɷ֣�Ҳ���ɿ�����ϳ�.����˵������ȷ����

A�����������������̼ԭ�ӿ��ܴ���ͬһ��ƽ����
B��1molCPAE����������ˮ��Ӧ���������3molBr2
C��1mol���Ҵ���O2����ȫȼ�գ�������10molO2
D��1molCPAE��������NaOH��Һ��Ӧ���������3molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤��SO2���������ԣ��ɽ�SO2ͨ��
A. ��ˮ B. ������
C. Ʒ����Һ D. ��ɫʯ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���ҳ��õ�һ�ֻ�ѧ�Լ���ij�����Լ�ƿ�ϱ�ǩ�IJ���������ͼ��ʾ�����ñ�ǩ�ṩ����Ϣ���ش��������⣺
��1�������Ħ������Ϊ ��
��2������������Һ���ܶ�Ϊ1.02g/cm3�����������Һ�����ʵ���Ũ�ȡ�
��3��ijʵ����Ҫ��2 mol��L-1��������Һ306ml������ȡ������������Һ���ٺ�������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����״���£�5.6LCH4������Ϊ �ˣ������� ��ԭ�ӡ�
��2��������ͬ�� HCl��NH3��CO2��O2���������У����з�����Ŀ���ٵ��� �������ʽ����ͬ��������ͬ�¶Ⱥ���ͬѹǿ�����£���������� ��
��3����������27.9gˮ���ܽ�12.1g Cu��NO3��2��3H2Oǡ�ôﵽ���ͣ�������Һ�ܶ�Ϊ1.20g /cm3�������Һ��NO3�������ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������Ͳ�ڵ�����ѹ������Ͳ�ڣ������±�����ʵ�飬��ʵ������������������
��������ͬ��ͬѹ�²ⶨ��
![]()
ѡ�� | ����Ͳ������ | ����Ͳ������ | ����Ͳ������ |
A | 20mLH2S | 10mLSO2 | ���ɻ�ɫ���壬�����Զ�����ѹ�� |
B | 1g��ͭƬ | 10mL12mol/LŨ���� | ������ɫ���塢��Һ����ɫ�������Զ����ƣ�Cu��ʣ�� |
C | 30mLNO2 | 10mLˮ��Һ̬�� | ʣ����ɫ���壬�����Զ�����ѹ�� |
D | 10mLFeSO4��Һ | 10mLNH3 | ���ɰ�ɫ���������ճ���ת��Ϊ���ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2molPCl3��1molCl2�������������ܱ������У���һ�������·���������Ӧ��PCl3(g)+Cl2(g) ![]() PCl5(g)����ƽ��ʱPCl5Ϊ0.4mol�������ʱ����1.0molPCl3��0.5molCl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ�����
PCl5(g)����ƽ��ʱPCl5Ϊ0.4mol�������ʱ����1.0molPCl3��0.5molCl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ�����
A��0.4mol B����0.2mol
C������0.2mol D������0.2mol����0.4mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com