
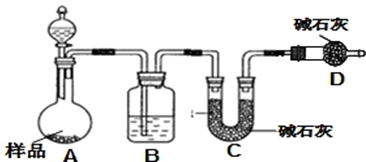
分析 (1)方案一原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3=Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸汽H2O的量或残留的固体的量推算出小苏打样品中纯碱的质量分数;
(2)方案二原理为一定量混合样品与足量的稀硫酸分别发生如下反应Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,2 NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O↑,根据所产生的CO2的质量,可以分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数.该方案关键是要获得产生的CO2的质量,自然在实验前要检查装置的气密性,要将装置中的CO2全部被碱石灰所吸收,要称量碱石灰在吸收CO2前后的质量;
①制备气体实验,实验前应先检验装置气密性;
②盐酸具有挥发性,会影响实验结果,D干燥管中的碱石灰吸收空气中的水蒸气、二氧化碳,防止进入C;
③实验根据C装置前后质量变化判断生成二氧化碳的质量;
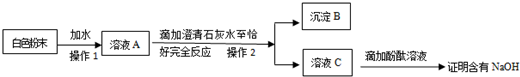
(3)方案三原理为在样品中加入BaCl2溶液,其中Na2CO3可与BaCl2发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,而NaHCO3与BaCl2则不反应.从而根擗产生的沉淀量,得出纯碱的质量分数,方案关键是测定BaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好,
①根据过滤具体操作判断所需仪器;
②试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
③在一定量样品中加入足量Na2CO3可与BaCl2发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,而NaHCO3与BaCl2则不反应,根据BaCO3沉淀的量,就可得出纯碱的质量分数.
解答 解:(1)实验中加热时碳酸氢钠发生分解,反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)①该方案是要获得产生的CO2的质量,在实验前要检查装置的气密性,
故答案为:检查装置的气密性;
②盐酸具有挥发性,会影响实验结果,所以选择稀硫酸;D干燥管中的碱石灰吸收空气中的水蒸气、二氧化碳,防止进入C被吸收,减少误差,
故答案为:吸收空气中的水蒸气、二氧化碳,防止进入C被吸收;
③根据所产生的CO2的质量及样品质量,分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数,所以需称量C装置前后质量变化判断生成二氧化碳的质量.
故答案为:C;
(3)①过滤操作中,除了烧杯外还用到漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
②试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全,
故答案为:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
③在一定量样品中加入足量Na2CO3可与BaCl2发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,而NaHCO3与BaCl2则不反应,根据题意可知,BaCO3沉淀的质量为19.7g,即为0.1mol,所以碳酸钠的物质的量为0.1mol,即质量为10.6g,所以纯碱的质量分数为$\frac{10.6g}{20g}$×100%=53%,
故答案为:53%.
点评 本题以实验探究“测定放置已久的小苏打样品中纯碱的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,题目难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O-C-O | B. | 过氧化钠的电子式: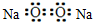 | ||
| C. | 丙烷分子的球棍模型: | D. | Cl-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
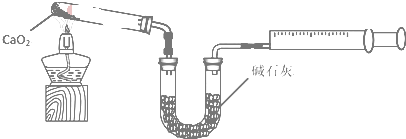
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数目为NA | |
| D. | 1molH2在O2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠和水反应 Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | Ca(ClO)2溶液中通入少量二氧化碳:ClO-+H2O+CO2=HClO+CO32- | |
| D. | 向氯化铝溶液中滴入足量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>W | |
| B. | Z的最高价氧化物的水化物为强酸 | |
| C. | 非金属性最强的元素为W | |
| D. | XW2分子中各原子最外层电子均达到8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com