
元素周期表中电负性最大的元素是
A. Fr B. F C. H D. N
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2013-2014江苏省南京市雨花区高一下学期期末考试化学试卷(解析版) 题型:选择题
用铁片与2mol/L稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是
A.滴加NaCl溶液 B.加热
C.换用4mol/L硫酸 D.换用铁粉
查看答案和解析>>
科目:高中化学 来源:2013-2014广西贵港市毕业班5月高考冲刺模拟理综化学试卷(解析版) 题型:选择题
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原
B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后, c(Na2SO4)不变,且溶液中有晶体析出
D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
下列有关叙述中,不可以用氢键来解释的是
A.0℃时,水的密度大于冰的密度 B.水的熔沸点高于硫化氢的熔沸点
C.氟化氢气体极易溶于水 D.氟化氢比氯化氢稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
下列平衡常数中,表示的正反应程度最大的是
A.K= B.K=
B.K= C.K=1 D.K=1010
C.K=1 D.K=1010
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:实验题
(15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
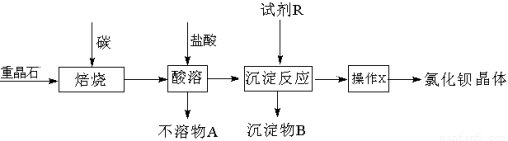
(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是 (填字母编号)。
a.用澄清石灰水吸收气体 b.用浓硫酸吸收气体 c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是 (写两个)。
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于 (填仪器名称)中冷却;④ ;⑤恒重操作。恒重操作的目的是 ;若最终测出的n值偏大,可能的实验操作误差原因是 (举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验: (用装置代号以“A
 ……
…… ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
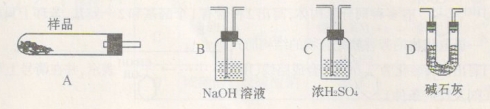
(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。

查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A、pH=1的溶液:Fe2+、NO3-、SO42-、Na+
B、c(H+)/c(OH-)=1012的溶液:NH4+、Al3+、NO3-、Cl-
C、c(Fe3+)=0.1 mol·L-1的溶液:K+、ClO-、SO42-、SCN-
D、水电离的c(H+)=l×10-14mol·L-1的溶液:Ca2+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是( )
| A.①③⑤ | B.①②⑤ | C.①⑤⑥ | D.①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组用0.55 mol/L NaOH溶液和0.50 mol/L盐酸反应来测定中和热,实验装置如下图所示。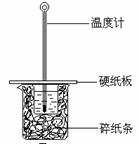
(1)图示实验装置中缺少的一种仪器是 ,大、小烧杯间填满碎纸条的作用是 。
(2)取50 mL NaOH溶液和50mL盐酸进行实验,实验数据如下表:
①请填写下表中的空白:
| 温度 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.1 | 3.0 |
| 2 | 25.9 | 25.9 | 25.9 | 28.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com