
0.1 mol·L-1某酸HA溶液的pH=2,则该溶液中有关浓度关系式正确的是
A.c(H+)>c(A-) B.c(H+)>c(HA) C.c(OH-)>c(HA) D.c(HA)>c(A-)
AD
解析试题分析:c(酸)= 0.1 mol/L,pH=2,c(H+)=0.01mol/L< c(酸).所以该酸是弱酸。A. 在溶液中除了存在酸的电离平衡HA H+ +A-,外还存在水的电离平衡:H2O
H+ +A-,外还存在水的电离平衡:H2O H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
考点:考查弱电解质溶液中各种微粒的浓度的关系的知识。


科目:高中化学 来源: 题型:单选题
25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是
| A.溶液中的 c(OH-) = 1×10-10 mol·L-1 |
| B.溶液中的c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.溶液中的c(H+) + c(NH4+) = c(Cl-) + c(OH-) |
| D.溶液中的c(NH3·H2O) = c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是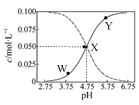
| A.Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为10—4.75 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液 :c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A===HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,pH=11的氨水溶液和pH=1的盐酸溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
| A.弱碱的浓度大于强酸的浓度 |
| B.反应完全后的溶液呈碱性 |
| C.原氨水中有1%的含氮微粒为NH4+ |
| D.反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某学生用碱式滴定管量取0.1 mol·L-1的NaOH溶液,开始时仰视液面读数为1.00 mL,取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体体积为( )
| A.大于10.00 mL | B.小于10.00 mL |
| C.等于10.00 mL | D.等于11.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25℃时一些难溶物质的溶度积常数如下:
| 化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
| 溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
| A.A点时pH=1 |
| B.恰好完全沉淀时Ba(OH)2的体积为2 L |
C.B点时,溶液中的离子浓度关系为c(Na+)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| D.C点时pH=14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com