
分析 (1)钠元素的化合价为+1价,氧元素化合价为-2价,硅元素化合价为+4价氢元素化合价为+1价,根据化合价规则确定铁元素的化合价;根据硅酸盐改写成氧化物形式时:活泼的金属氧化物写在前面,再写SiO2,含有氢元素的H2O最后写,将矿青石棉改成氧化物形式,据此求算铁的氧化物的物质的量分数;
(2)在硅酸盐中,Al3+很容易取代Si4+,取代后不会引起原硅酸盐结构大的变化,可能两者微粒半径相差不大.
解答 解:(1)钠元素的化合价为+1价,氧元素化合价为-2价,硅元素化合价为+4价氢元素化合价为+1价,根据化合价规则,设铁的化合价为x,则1×2+5x+4×8-2×22-1×2=0,得x=2.4,确定铁元素的化合价为+2.4,Na2Fe5Si8O22(OH)2氧化物的形式:Na2Fe5Si8O22(OH)2→Na2O•8SiO2•H2O,但还有5个Fe和6个O,联想常见Fe的氧化物,可写出Fe2O3•3FeO,故其氧化物形式为Na2O•3FeO•Fe2O3•8SiO2•H2O,因Fe的氧化物可写出Fe2O3•3FeO,故FeO的物质的量分数为75%,Fe2O3的物质的量分数为25%,
故答案为:+2.4;FeO的物质的量分数为75%,Fe2O3的物质的量分数为25%;
(2)“硅酸盐结构”“立体几何”都启示我们从Al3+和Si4+的半径考虑:因Al3+和Si4+的半径相差不大,故插入后不会引起晶体结构的变化,
故答案为:Al3+和Si4+的半径相差不大.
点评 本题以社会热点为背景,依托石棉知识考查了硅酸盐的有关知识,题目难度中等,侧重考查了学生摄取信息、分析问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陈醋 | B. | 食盐 | C. | 味精 | D. | 花生油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
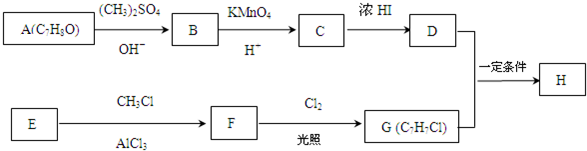
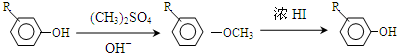
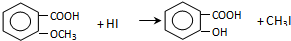 .
.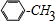 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$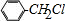 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.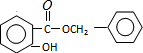 .
. (或
(或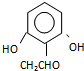 .
.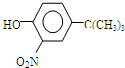
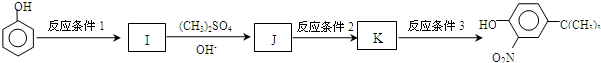
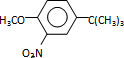 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②中红色褪去的原因是SO2将SCN-还原 | |
| B. | ①中红色褪去的原因是KMnO4将SCN-氧化 | |
| C. | ②中红色褪去的原因是SO2将Fe3+还原成Fe2+ | |
| D. | SCN-在适当条件下可失去电子被氧化为(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜跟硝酸反应 Cu2++O2-+2H+═Cu+H2O | |
| B. | 碳酸镁跟硝酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | 铜跟稀硝酸反应 Cu+4H++NO3-═Cu2++NO↑+2H2O | |
| D. | 铁跟浓硝酸共热 Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
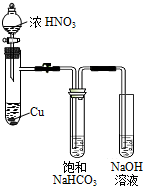 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com