
”¾ĢāÄæ”æøł¾ŻµēĄėĘ½ŗā³£Źż(ÓĆKa±ķŹ¾)µÄ“óŠ”æÉŅŌÅŠ¶Ļµē½āÖŹµÄĻą¶ŌĒæČõ”£25”ꏱ£¬ÓŠ¹ŲĪļÖŹµÄµēĄėĘ½ŗā³£ŹżČēĻĀ±ķĖłŹ¾£ŗ
»ÆѧŹ½ | HF | H2CO3 | HClO | H2SO3 |
µēĄėĘ½ŗā³£Źż(Ka) | Ka=7.2”Į10-4 | Ka1=4.2”Į10-7 Ka2=5.6”Į10-11 | Ka=3.0”Į10-8 | Ka1=1.0”Į10-2 Ka2=5.0”Į10-8 |
£Ø1£©25”ꏱ£¬Ķ¬ÅØ¶ČµÄHF”¢H2CO3”¢HClOČżÖÖČÜŅŗÖŠ£¬pH×ī“óµÄŹĒ____________(Š“»ÆѧŹ½)”£
£Ø2£©½«0.1mol”¤L-1µÄHFČÜŅŗ1mL¼ÓĖ®Ļ”ŹĶÖĮ10mL(¼ŁÉčĪĀ¶Č²»±ä)£¬ĻĀĮŠø÷ĮæŌö“óµÄŹĒ___________(ĢīŠ“×ÖÄø)”£
A£®c(H+) B£®c(H+)”¤c(OH-) C£®c(H+)/c(HF) D£®c(OH-)/c(H+)
£Ø3£©25”ꏱ£¬ĻÖÓŠĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1mol”¤L-1µÄĻĀĮŠĖÄÖÖČÜŅŗ£ŗ
¢ŁNa2CO3ČÜŅŗ ¢ŚNaHCO3ČÜŅŗ ¢ŪNaFČÜŅŗ ¢ÜNaClOČÜŅŗ”£
ŅĄ¾ŻŹż¾ŻÅŠ¶ĻĘäpHÓɓ󵽊”µÄĖ³ŠņŹĒ_________________________(ĢīŠ“ŠņŗÅ)”£
£Ø4£©øł¾ŻH2SO3µÄµēĄėĘ½ŗā³£Źż,¼ĘĖć25”ꏱ,0.05mol”¤L-1Na2SO3ČÜŅŗµÄpH=__________”£
ČōijNa2SO3ŗĶNaHSO3µÄ»ģŗĻŅŗ³ŹÖŠŠŌ£¬ŌņČÜŅŗÖŠc(SO32-)__________c(HSO3-)(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”°»ņ”°µČÓŚ")”£
”¾“š°ø”æ HClO C D £¾¢Ü£¾¢Ś£¾¢Ū 10 Š”ÓŚ
”¾½āĪö”æ£Ø1£©²éæ“ČżÖÖĖįµÄµēĄėĘ½ŗā³£Źż£¬¶žŌŖČõĖį擵ŚŅ»²½µēĄė£»Ę½ŗā³£ŹżŌ½“ó£¬ĖįŠŌŌ½Ē棬pHŌ½Š”£¬ÕżČ·Ń”ĻīHClO£»
£Ø2£©HFĪŖČõĖį£¬“ęŌŚµēĄėĘ½ŗā£¬¼ÓĖ®Ļ”ŹĶ£¬Ę½ŗāÓŅŅĘ£¬c(H+)”¢c(HF)”¢c(F-)¾ł¼õÉŁ£¬ĪĀ¶Č²»±ä£¬c(H+)”¤c(OH-)ĪŖ³£Źż£¬ĖłŅŌc(OH-)Ōö“ó£»A£®c(H+) ¼õÉŁ£»B£®c(H+)”¤c(OH-)²»±ä£»C£®c(H+)/c(HF)Ōö“ó£»D£®c(OH-)/c(H+)Ōö“ó£»ÕżČ·Ń”Ļī£ŗCD£»
£Ø3£©øł¾ŻŠĪ³ÉøĆÄĘŃĪµÄČõĖįµÄĖįŠŌĒæČõ½ųŠŠÅŠ¶Ļ£¬ĖįŌ½Čõ£¬ŠĪ³ÉµÄÄĘŃĪŌ½Ņ×Ė®½ā£¬ČÜŅŗµÄ¼īŠŌ¾ĶŌ½Ē棻øł¾ŻÉĻŹöČżÖÖĖįµÄµēĄėĘ½ŗā³£Źż£ŗK(HF)> K(H2CO3) > K(HClO) > K(HCO-3)
ĖÄÖÖŃĪµÄpHÓɓ󵽊”µÄĖ³ŠņŹĒ£ŗNa2CO3ČÜŅŗ> NaClOČÜŅŗ> NaHCO3ČÜŅŗ> NaFČÜŅŗ£»ÕżČ·“š°øĪŖ£ŗ ¢Ł£¾¢Ü£¾¢Ś£¾¢Ū£»
£Ø4£©Ė®½ā·“Ó¦ĪŖSO32-+H20![]() HSO3-+OH-£¬ÉčĖ®½ā²śÉśµÄc(OH-)=c(HSO3-)= xmol/L £»Ė®½āĘ½ŗā³£ŹżĪŖKh=c(OH-)”Įc(HSO3-)/c(SO32-)=KW/Ka2=1”Į10-14/5.0”Į10-8=2”Į10-7; X2/(0.05-x)= 2”Į10-7£¬½üĖĘ¼ĘĖć£ŗX=10-4mol/L£»c(H+)=10-10£¬ pH=10£»“š°øĪŖ10£»
HSO3-+OH-£¬ÉčĖ®½ā²śÉśµÄc(OH-)=c(HSO3-)= xmol/L £»Ė®½āĘ½ŗā³£ŹżĪŖKh=c(OH-)”Įc(HSO3-)/c(SO32-)=KW/Ka2=1”Į10-14/5.0”Į10-8=2”Į10-7; X2/(0.05-x)= 2”Į10-7£¬½üĖĘ¼ĘĖć£ŗX=10-4mol/L£»c(H+)=10-10£¬ pH=10£»“š°øĪŖ10£»
£Ø5£©HSO3-Ąė×Ó¼ČÄÜĖ®½āÓÖÄܵēĄė£¬NaHSO3ČÜŅŗ³ŹĖįŠŌĶ¬Ź±ĖµĆ÷HSO3-µÄµēĄė³Ģ¶Č“óÓŚĖ®½ā³Ģ¶Č£¬Na2SO3Ė®½āĻŌ¼īŠŌ£¬ĒŅĖ®½āÄÜĮ¦½ĻĒ棬ֻӊHSO3-Ąė×ÓÅØ¶Č“óÓŚSO32-Ąė×ÓÅØ¶Č£¬²Å»įŹ¹¶žÕߵĻģŗĻČÜŅŗ³ŹĻÖÖŠŠŌ£¬“š°øĪŖ£ŗŠ”ÓŚ£»


 øßÖŠ±ŲĖ¢ĢāĻµĮŠ“š°ø
øßÖŠ±ŲĖ¢ĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹö“ķĪóµÄŹĒ
A. n(H2CO3)ŗĶn(HCO3-)Ö®ŗĶĪŖ1molµÄNaHCO3ČÜŅŗÖŠ£¬ŗ¬ÓŠNa+ŹżÄæĪŖNA
B. 17gH2O2Ėłŗ¬·Ē¼«ŠŌ¼üŹżÄæĪŖ0.5NA
C. ±ź×¼×“æöĻĀ£¬H2ŗĶCO»ģŗĻĘųĢå8.96LŌŚ×ćĮæO2ÖŠ³ä·ÖČ¼ÉÕĻūŗÄO2·Ö×ÓŹżĪŖ0.2NA
D. 56gĢśÓė×ćĮæĀČĘų·“Ó¦£¬ĀČĘų¹²µĆµ½3NAøöµē×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
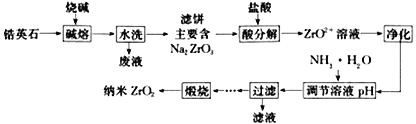
”¾ĢāÄæ”æÄÉĆ׶žŃõ»ÆļÆ(ZrO2)ŹĒÖʱøĢŲÖÖĢÕ“É(china)×īÖŲŅŖµÄŌĮĻÖ®Ņ»”£ÓÉļÆÓ¢ŹÆ(Ö÷ŅŖ³É·ÖĪŖZrSiO4)Öʱø¶žŃõ»ÆļƵŤŅÕĮ÷³ĢČēĶ¼ĖłŹ¾£ŗ
£Ø1£©Š“³ö”°¼īČŪ”±Ź±Ö÷ŅŖ·“Ó¦µÄ»Æѧ·½³ĢŹ½__________________________________”£
£Ø2£©”°Ė®Ļ“”±Ėł²śÉśµÄ”°·ĻŅŗ”±Ö÷ŅŖ³É·ÖĪŖNaOH ŗĶ__________£ØĢī»ÆѧŹ½£©£¬ŹŌŠ““Ė³É·ÖµÄŅ»ÖÖÓĆĶ¾________________________________”£
£Ø3£©Š“³ö”°Ėį·Ö½ā”±Éś³ÉZrO2+·“Ó¦µÄĄė×Ó·½³ĢŹ½__________________________________”£
£Ø4£©øł¾ŻĶ¼£Ø1£©·ÖĪöZrO2+ÅØ¶Č¶ŌZrO2Į£¾¶µÄÓ°Ļģ_____________________________________”£
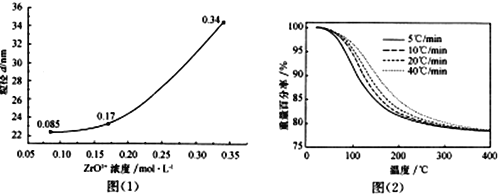
£Ø5£©ZrO2+ČÜŅŗÖŠ³£ŗ¬ÓŠFe3+£ØÅضČĪŖ0.03mol”¤L-l£©£¬Ņ»°ćÓĆ²ŻĖįĀēŗĻ“¦Ąķ¾»»Æ”£ČōĪ“¾»»Æ“¦ĄķÖ±½Ó¼ÓČė°±Ė®µ÷½ŚČÜŅŗpH£¬ÄÜ·ńŹ¹ZrO2+ĶźČ«×Ŗ»ÆĪŖ“æ¾»µÄZrO(OH)2³Įµķ£¬ŹŌĶعż¼ĘĖćĖµĆ÷”£ŅŃÖŖZrO2+ĶźČ«³ĮµķŹ±ÅضČĪŖ1.0”Į10 -5 mol”¤L-l £¬ZrO(OH)2”¢Fe(OH)3µÄKsp·Ö±šĪŖ4.0”Į10-26”¢8.0”Į10-38£¬ ![]() ”Ö3.16”£__________________________________________________”£
Ӆ3.16ӣ__________________________________________________ӣ
£Ø6£©ZrO(OH)2ģŃÉÕÖĘČ”ÄÉĆ×ZrO2Ź±£¬ÉżĪĀĖŁĀŹÓėÖŲĮæ°Ł·ÖĀŹÖ®¼äµÄ¹ŲĻµČēĶ¼£Ø2£©ĖłŹ¾”£
ģŃÉÕŹ±×ī¼ŃÉżĪĀĖŁĀŹĪŖ________________£¬ĄķÓÉŹĒ______________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆH2S·ĻĘųÖĘČ”H2µÄ·½·ØÓŠĄūÓŚ»·±£”£
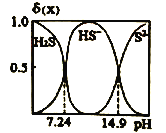
(l) H2SµÄµē×ÓŹ½ŹĒ____£¬H2SČÜŅŗÖŠH2S”¢HS-£¬S2-µÄĪļÖŹµÄĮæ·ÖŹż¦Ä(X)ĖępHµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬H2SµÄµēĄėĘ½ŗā³£Źżka1= ___________
![]()
(2)ĄūÓĆH2S·ĻĘųÖĘČ”H2µÄ·½·ØÓŠ¶ąÖÖ”£
¢ŁČČ»ÆѧĮņµāŃ»··Ø ŅŃÖŖŃ»··“Ó¦ČēĻĀ£ŗ
H2S£Øg£©+ H2SO4£Øaq£©ØTS(s)+ SO2£Øg£©+2 H2O£Øl£©”÷H1=61 kJ/mol
SO2£Øg£©+I2£Øg£©+2 H2O£Øl£©=2HI£Øaq£©+ H2SO4£Øaq£©”÷H2=-151 kJ/mol
2HI£Øaq£©= H2(g)+ I2£Øg£©”÷H3=110kJ/mol
Š“³öĮņ»ÆĒāĘųĢå·Ö½āĪŖĒāĘųŗĶ¹ĢĢåĮņµÄČČ»Æѧ·½³ĢŹ½_____”£
¢ŚøßĪĀČČ·Ö½ā·Ø
ŅŃÖŖ£ŗH2S (g) =H2(g)+l/2S2£Øg£©
ŌŚŗćĪĀĆܱÕČŻĘ÷ÖŠ£¬æŲÖĘ²»Ķ¬ĪĀ¶Č½ųŠŠH2S·Ö½āŹµŃ锣ŅŌH2SĘšŹ¼ÅØ¶Č¾łĪŖcmol/L£¬²ā¶ØH2SµÄ×Ŗ»ÆĀŹ£¬H2SµÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č¹ŲĻµČēĶ¼ĖłŹ¾”£¾ŻĶ¼æÉÖŖ£ŗĪĀ¶ČÉżøßĘ½ŗā³£ŹżK_______£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£Čō985”ęŹ±Ę½ŗā³£ŹżK=0.04£¬ŌņĘšŹ¼ÅضČc= ______mol/L ”£
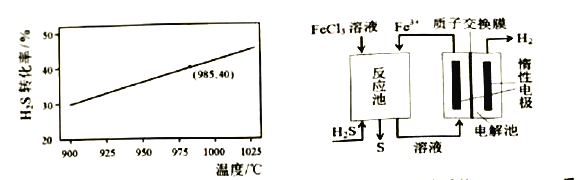
¢Ūµē»Æѧ·Ø øĆ·ØÖĘĒā¹ż³ĢµÄŹ¾ŅāĶ¼ČēÉĻĶ¼”£Ń»·ĄūÓƵÄĪļÖŹŹĒ____”£·“Ó¦³ŲÖŠ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ______”£µē½ā³ŲŃō¼«µē¼«·“Ó¦Ź½ĪŖ____ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©Š“³öĻĀĮŠĪļÖŹŌŚĖ®ÖŠµÄµēĄė·½³ĢŹ½£ŗ
¢ŁBa(OH)2£ŗ________________________________________________£»
¢ŚKAl(SO4)2£ŗ____________________________________________”£
£Ø2£©Š“³öĻĀĮŠĪļÖŹ·¢ÉśĖ®½āµÄĄė×Ó·½³ĢŹ½£ŗ
¢ŁNaClO£ŗ________________________________________________________£»
¢ŚFeCl3£ŗ_______________________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”滚Ņ©ŹĒÖŠ¹śµÄ”°ĖÄ“ó”±·¢Ć÷£¬ÓÉKNO3ŗĶĮ½ÖÖ·Ē½šŹōŌŖĖŲAŗĶBµÄµ„ÖŹ×é³É£¬AĪŖŗŚÉ«¹ĢĢ壬BĪŖµ»ĘÉ«µÄ¹ĢĢ壬ŌņĻĀĮŠÓŠ¹ŲĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø £©
A.ŌŖĖŲAÓėNŗĶOĶ¬ÖÜĘŚ£¬BÓėOĶ¬Ö÷×å
B.A£¬B·Ö±šÓėO×é³ÉµÄ»ÆŗĻĪļAOŗĶBO2¾łŹĒ“óĘųµÄĪŪČ¾Īļ
C.AŗĶB·Ö±šÓėO×é³ÉµÄ»ÆŗĻĪļ¾łÄÜÓėÉÕ¼ī·“Ó¦
D.µ„ÖŹAŌŚŅ»¶ØĢõ¼žĻĀæÉÓėBµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļ·¢Éś·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĢžŗĶäåĖ®·“Ó¦ŗóµÄ²śĪļĪŖ2£¬2£¬3£¬3£ĖÄä嶔Ķ飬ŌņøĆĢžµÄĶ¬·ÖŅģ¹¹ĢåĪŖ
A. 1-¶”Č² B. 2-¶”Č² C. 1-¶”Ļ© D. 2-¶”Ļ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ½¾æNa2S2O3+H2SO4=Na2SO4+SO2”ü+S”ż+H2O ·“Ó¦µÄĖŁĀŹÓ°ĻģŅņĖŲ£¬Éč¼ĘĮĖŅŌĻĀŹµŃ飬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
׶ŠĪĘæ | 0.1molLNa2S2O3 ČÜŅŗ/mL | ÕōĮóĖ® | 0.2mol/L H2SO4 ČÜŅŗ | ·“Ó¦ĪĀ¶Č | »ė×Ē³öĻÖŹ±¼ä/s | ±ø×¢ |
1 | 10 | 0 | 10 | 20”ę | 10 | |
2 | 10 | 5 | 5 | 20”ę | 16 | |
3 | 10 | 0 | 10 | 50”ę | 5 | µŚ10 ĆėæŖŹ¼»ė×Ē²»ŌŁŌö¶ą |
4 | 10 | 6 | 4 | 50”ę | 8 |
A. øĆ·“Ó¦Ņ²æÉĶعż²āSO2µÄĢå»ż±ä»ÆĄ“±ķŹ¾»Æѧ·“Ó¦ĖŁĀŹµÄæģĀż
B. 3ŗÅĘæÓĆNa2S2O3 Ą“±ķŹ¾ĖŁĀŹĪŖ0£®0lmol/(Ls)
C. ÓÉ2ŗÅĘæŗĶ3ŗÅĘæŹµŃé½į¹ūæɵĆĪĀ¶ČŌ½øß·“Ó¦ĖŁĀŹŌ½æģ
D. ÓÉ1ŗÅĘæŗĶ4ŗÅĘæŹµŃé½į¹ūæɵĆĪĀ¶ČŌ½øß·“Ó¦ĖŁĀŹŌ½æģ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ5X£ + XO3-+ 6H£«£½3X2 + 3H2O£¬ĻĀĮŠ¹ŲÓŚ¶ĢÖÜĘŚŌŖĖŲXŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖƵÄĖµ·ØÕżČ·µÄŹĒ
A.µŚ¶žÖÜĘŚVA×åB.µŚ¶žÖÜĘŚVIIA×å
C.µŚČżÖÜĘŚVA×åD.µŚČżÖÜĘŚVIIA×å
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com