
根据元素周期表和元素周期律,下列推断中错误的是
A. 砹是一种有色固体,它的气态氢化物很不稳定,
B. F2与水反应比Cl2与水反应剧烈
C. 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱
D. 溴化氢比氯化氢稳定,HClO4酸性强于HBrO4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年山东省枣庄市北校区高一下学期第一次月考化学试卷(解析版) 题型:选择题
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素。下面关于它的原子结构和性质预测正确的是
A. 类铅元素原子的最外层电子数为4 B. 其常见价态为+2、+3、+4
C. 它的金属性比铅弱 D. 它的原子半径比铅小?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:简答题
认真观察下列装置,回答下列问题:
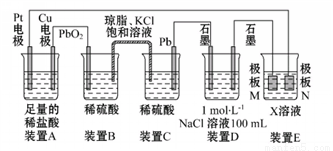
(1)装置B中PbO2上发生的电极反应方程式为__________________。
(2)装置A中总反应的离子方程式为____________________________。
(3)装置D中总反应的离子方程式为_____________________________。
(4)若装置E的目的是在Cu材料上镀银,则X为________,极板N的材料为__________。
(5)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
下列各离子组在指定的溶液中一定能大量共存的是
①常温在c(H+)/c(OH-)=10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常温pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水电离出的H+浓度c(H+)=10﹣12mol•L?1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙变红色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A.①②③ B.①②④ C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市南校区高一3月月考化学试卷(解析版) 题型:选择题
关于化学键的下列叙述中,正确的是
A. 构成物质的分子中一定含有化学键 B. 离子化合物可能含共价健
C. 共价化合物可能含离子键 D. 离子化合物中一定含有金属元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市南校区高一3月月考化学试卷(解析版) 题型:选择题
两种微粒的质子数和电子数均分别相等,它们不可能是
A. 一种阳离子和一种阴离子
B. 一种单质和一种化合物分子
C. 两种不同的分子
D. 一种原子和一种分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市南校区高一3月月考化学试卷(解析版) 题型:选择题
下列化合物中阳离子半径与阴离子半径之比最大的是
A. LiI B. NaBr C. KCl D. CsF
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期第一次月考化学试卷(解析版) 题型:填空题
用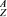 X表示原子:
X表示原子:
(1)中性原子的中子数:N=________。
(2)阳离子的中子数:AXn+共有x个电子,则N=________。
(3)阴离子的中子数:AXn-共有x个电子,则N=________。
(4)中性分子中子数:12C18O2分子中,N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为________mol。
(6)某元素的同位素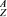 X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:
X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:
①Z值和A值:Z=________,A=________;
②X元素在周期表中的位置_____________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A. 第3周期所含元素中钠的第一电离能最小
B. 铝的第一电离能比镁的第一电离能大
C. 在所有的元素中,F的第一电离能最大
D. 钾的第一电离能比镁的第一电离能大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com