
【题目】如图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式. 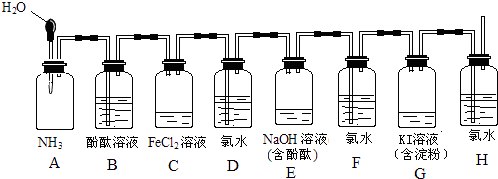
(1)A中的现象为 , 化学方程式 .
(2)C中的现象为 , 离子方程式 .
(3)E中的现象为 , 离子方程式 .
(4)G中的现象为 , 离子方程式 .
【答案】
(1)B中无色溶液倒吸入A中,且变为红色; NH3+H2O?NH3?H2O?
(2)溶液由浅绿色变为黄色;2Fe2++Cl2=2Fe3++2Cl﹣
(3)溶液红色褪去; Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(4)溶液变为蓝色; Cl2+2I﹣=I2+2Cl﹣
【解析】解:(1)氨气极易溶于水,将胶头滴管中的水挤入集气瓶,引发喷泉,则观察到B中无色溶液倒吸入A中,且变为红色,溶液变红是因发生电离反应为NH3H2ONH4++OH﹣,氨气与水反应生成一水合氨,方程式:NH3+H2ONH3H2O;所以答案是:B中无色溶液倒吸入A中,且变为红色;NH3+H2ONH3H2O;(2)氯水进入C中,发生氧化还原反应生成氯化铁,观察到C中溶液由浅绿色变为黄色,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl﹣,
所以答案是:溶液由浅绿色变为黄色;2Fe2++Cl2=2Fe3++2Cl﹣;(3)氯水进入E中,发生氧化还原反应生成NaCl、NaClO和水,观察到E中溶液红色褪去,离子反应为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:溶液红色褪去;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(4)氯水进入G中,与KI发生氧化还原反应生成碘单质,淀粉遇碘变蓝,观察到G中溶液变为蓝色,发生的离子反应为Cl2+2I﹣=I2+2Cl﹣,
所以答案是:溶液变为蓝色;Cl2+2I﹣=I2+2Cl﹣.
【考点精析】解答此题的关键在于理解氯气的化学性质的相关知识,掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应,以及对氨的化学性质的理解,了解与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一恒温恒容密闭容器中充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )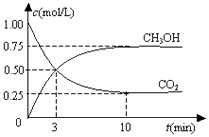
A.反应进行到3 min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.第3 min时,氢气的平均反应速率为1.5mol/(L?min)
D.该温度下,反应的平衡常数的值为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将11.2LCO2缓缓通入300mL2mol·L-1的NaOH溶液中,待充分反应后将所得溶液蒸干并充分灼烧,最后所得固体物质的质量为
A. 31.8g B. 53g C. 63.6g D. 84g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA,0.1molC 和一定量的 B 三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段 c ( B)未画出].附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( ) 
A.该反应一定是放热反应
B.t4~t5阶段改变的条件为减小压强
C.B的起始物质的量为0.02mol
D.该反应的化学方程式为3A(g)+B(g)2C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只给出表中甲和乙对应的量,不能用来求物质的量的是
甲 | 乙 | |
① | 物质微粒数 | 阿伏加德罗常数 |
② | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
③ | 固体体积 | 固体密度 |
④ | 溶液质量分数 | 溶液体积 |
⑤ | 非标准状况下物质的质量 | 物质的摩尔质量 |
A. ②③④ B. ③④⑤ C. ③④ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如图所示. 
下列说法正确的是( )
A.Cl2和SO2均可以漂白有色物质,且漂白的原理相同
B.由SiO2+Na2CO3 ![]() Na2SiO3+CO2↑可知H2CO3的酸性强于H2SiO3
Na2SiO3+CO2↑可知H2CO3的酸性强于H2SiO3
C.工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3
D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿主要成分Al2O3,还含少量 SiO2、Fe2O3杂质。可用下图制备铝:
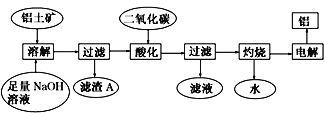
已知 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8↓+4NaOH。 回答下列问题:
(1)在工艺流程第五步中,灼烧所需的实验仪器除酒精灯、坩埚、坩埚钳、玻璃棒之外,还需要_____________、_________________________。
(2)Na2Al2Si2O8的氧化物形式为_________________________。
(3)滤渣A经多步可制得粗硅 ,请写出由二氧化硅制得粗硅的化学方程式________________。
(4)在工艺流程第三步中,通入过量的二氧化碳时,该反应的离子方程式有_______________, 得到的滤液与足量Ba(OH)2溶液反应的主要离子方程式为 ____________________。
(5)将a g铝土矿经过以上一系列操作之后,最终得到b g Al(不考虑实验过程中操作引起的损耗), 下列说法正确的是____________。 (NA表示阿伏加德罗常数)
A.铝土矿中 Al3+数目小于![]()
B.铝土矿中Al2O3物质的量小于b/54 mol
C.铝土矿中铝元素的质量分数为![]() ×100℅
×100℅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com