
准确配制一定物质的量浓度的NaOH溶液,下面实验操作中不正确的是( )
A. 用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中
B. 将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中
C. 定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切
D. 将称好的NaOH固体放入烧杯中,加入适量水溶解
科目:高中化学 来源: 题型:
有A、B、C、D、E、F六种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1。F+离子的3d轨道中电子全充满。回答下列问题:
(1)写出基态E原子的电子排布式──────────────── 。
(2)用电子式表示AE2的形成过程 。
(3)B、C两元素的第一电离能大小关系为:───>────(填写元素符号),原因是 。
(4)B元素的最低价氢化物分子立体构型为 。中心原子的杂化方式为 。
(5)向F2+离子的溶液中加入过量CH3的浓溶液,充分反应后溶液呈深蓝色,该反应的离子方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如下图),每次实验时,通过灵敏电流计测出电子流动方向如下:
|
| 所用金属 | 电子流向 |
| ① | A、Cu | A→Cu |
| ② | C、D | D→C |
| ③ | A、C | C→A |
| ④ | B、Cu | Cu→B |
| ⑤ | …… | …… |
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序是_____________________________。
(2)在①中,Cu片上观察到的现象是:_____________________________;
(3)在②中,溶液中H+向金属片________移动;
(4)在④中,两金属片上均无气泡放出。此时两金属片上的电极反应式分别为:
Cu:____________________________;B:_____________________________;
(5)如果实验⑤用B、D,则导线中电流方向为:_________(填B→D或D→B);
(6)已知反应:Cu+2Fe3+==Cu2++2Fe2+。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池并检验正极产物。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、双氧水、NaOH溶液
材料:Cu片、Fe片、石墨棒
a、设计电池应选用的试剂和材料是:__________________________________;
b、检验正极产物选用的试剂是_______________________,检验反应的离子方程式:
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
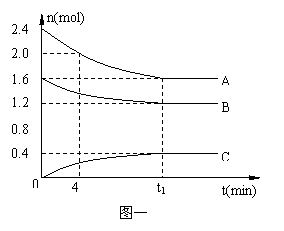
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
 | |||
 | |||
下列分析不正确的是:
A.0~4分钟时,A的平均反应速率为0.02mol/(L?min)
B.该反应的平衡常数表达式K=
C.由T1向T2变化时,正反应速率大于逆反应速率
D.此反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
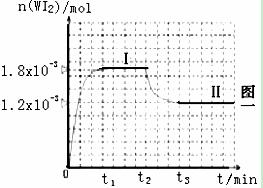
Ⅰ 碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g)  WI2(g)
WI2(g)
为模拟上述反应,在实验室中准确称
 取0.508 g 碘、0.736 g金属钨放置于50.0
取0.508 g 碘、0.736 g金属钨放置于50.0
mL密闭容器中,并加热使其反应。右图一
是混合气体中的WI2蒸气的物质的量随时
间变化关系的图像[n(WI2) ~ t],其中
曲线Ⅰ(0~t2时间段)的反应温度为450℃,
曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
请回答下列问题:
(1)该反应是 (填写“放热”“吸热”)反应。
(2)反应从开始到t1(t1= 3 min)时间内的平均速率υ(I2)= mol/(L.min)。
(3)在450℃时,计算该反应的平衡常数K= 。
(4)能够说明上述反应已经达到平衡状态的有 。
A.I2与WI2的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
 C.容器内混合气体的密度不再增加
C.容器内混合气体的密度不再增加
D.容器内气体压强不变化
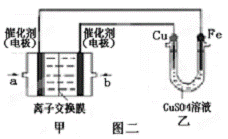
Ⅱ 图二中甲为甲醇燃料电池(电解质溶
液为KOH溶液),该同学想在乙中实
现铁上镀铜,则a处电极上发生的电
极反应式是 。
Ⅲ 已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热
分别为285.8 kJ·mol-1、283.0 kJ·mol-1和1365.5 kJ·mol-1。
反应 2CO(g)+4H2(g) CH3CH2OH(l)+H2O(l) 的△H= 。
CH3CH2OH(l)+H2O(l) 的△H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
通过分析元素周期表的结构和各元素性质的变化趋势,下列关于砹(原子序数为85)及其化合物的叙述中肯定不正确的是( )
A.由KAt的水溶液制备砹的化学方程式为2KAt+Cl2===2KCl+At2
B. AgAt是一种难溶于水的化合物
C.相同条件下HAt比HI稳定
D.At元素位于第六周期
查看答案和解析>>
科目:高中化学 来源: 题型:
将12.8gMg、Al、Fe组成的合金溶于足量的NaOH溶液中,可产生0.3mol气体。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,其质量为38.3g,则上述反应中生成NO气体的体积(标准状况下)为( )
A. 11.2L B. 33.6L C. 22.4L D.6.72L
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )
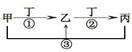
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,
则反应①的化学方程式4NH3+5O2 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的
量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com