
| 选项 | 实验操作 | 实验目的 |
| A. | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化. | 验证浓度对化学平衡的影响 |
| B. | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和硫酸中,观察气泡产生的快慢. | 验证固体接触面积对化学反应速率的影响 |
| C. | 相同温度下,两只试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量MnO2固体. | 验证不同催化剂对H2O2分解速率的影响 |
| D. | 将SO2气体通入溴水中,观察溶液颜色的变化 | 证明SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.KCl在该反应中实际上不参加反应,所以KCl浓度大小不影响平衡移动;
B.要验证固体接触面积对化学反应速率的影响,应该只有固体接触面积不同其它条件完全相同;
C.要验证不同催化剂对H2O2分解速率的影响,应该只有催化剂不同,其它条件完全相同;
D.二氧化硫具有还原性,能被强氧化剂氧化.
解答 解:A.KCl在该反应中实际上不参加反应,所以KCl浓度大小不影响平衡移动,所以不能实现实验目的,可以用氯化铁或KSCN溶液检验浓度对化学平衡移动的影响,故A错误;
B.要验证固体接触面积对化学反应速率的影响,应该只有固体接触面积不同其它条件完全相同,反应物接触面积及酸都不同,要想实现实验目的,应该都用相同浓度的稀盐酸,故B错误;
C.要验证不同催化剂对H2O2分解速率的影响,应该只有催化剂不同,其它条件完全相同,该实验中只有催化剂不同,其它因素都相同,可以实现实验目的,故C正确;
D.二氧化硫和溴发生氧化还原反应而使溴褪色,体现二氧化硫的还原性而不是漂白性,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化还原反应、化学反应速率影响因素判断等知识点,侧重考查学生理解、分析判断能力,明确实验原理及物质性质是解本题关键,注意二氧化硫漂白性和还原性的区别.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | NaOH | C. | H2SO4 | D. | HC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
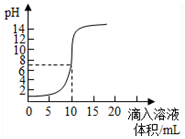
| A. | 原来盐酸的物质的量浓度为0.1mol•L-1 | |
| B. | 可以选择红色石蕊作为指示剂 | |
| C. | 氢氧化钠的物质的量浓度为0.1mol•L-1 | |
| D. | pH为7时加入的氢氧化钠的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在江河入海处易形成三角洲 | |
| B. | AgNO3溶液中滴入同浓度NaCl溶液,生成白色沉淀 | |
| C. | 卤水点豆腐 | |
| D. | 同一钢笔同时使用不同牌号的墨水易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA | |
| B. | 该反应配平后H+的化学计量数为6 | |
| C. | 该反应右边横线上的产物为OH- | |
| D. | 该反应的氧化剂为H2C2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
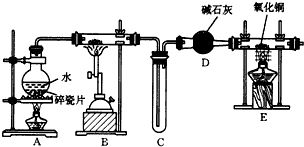
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
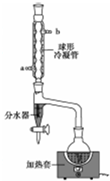 乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:
乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:| 物质名称 | 沸点/℃ | 熔点/℃ | 密度/g•cm-3 | 水中溶解度 |
| 正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
| 乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
| 乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com