
 CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。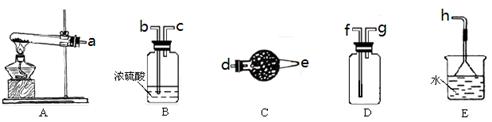
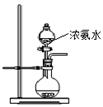
| A.碱石灰 | B.生石灰 | C.无水氯化钙 | D.无水硫酸铜 E.烧碱 |
科目:高中化学 来源:不详 题型:实验题
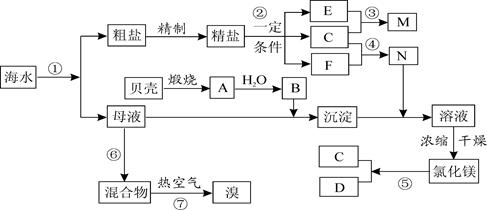
 单质处循环
单质处循环 (填“甲”或“乙”),理由是 。
(填“甲”或“乙”),理由是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
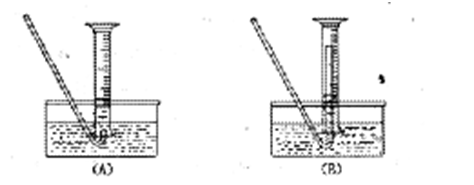
 不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
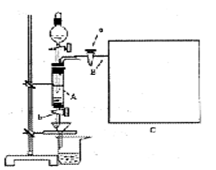
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
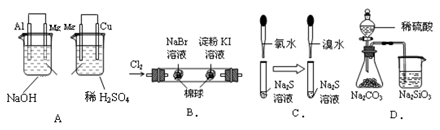
| 实验 | 实验现象 | 结论 |
| A. | 左烧杯中镁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Mg>Cu |
| B. | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C. | 左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 | 氧化性:Cl2>Br2>S |
| D. | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下: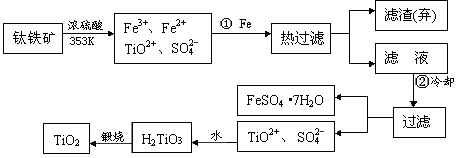
 TiCl4
TiCl4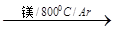 Ti
Ti 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
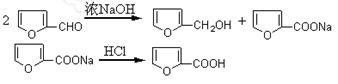
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
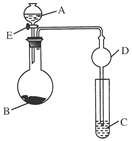
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com