
【题目】氨和肼(N2H4)都是氮元素的重要氢化物,在工农业生产、生活中有广泛应用。
(1)工业中常用以下反应合成氨:N2+3H2![]() 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
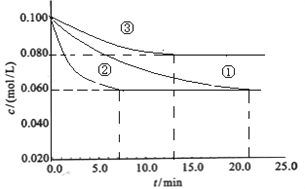
装罝③仅有一个反应条件与①不同,该条件为_______________,实验②平衡时H2的转化率为_____________;
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为_____________________________________________________。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为_________kJ。(假设空气中氧气的体积含量为20%,产物为液态水)
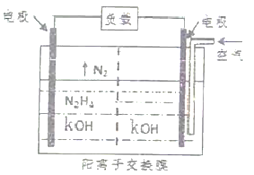
(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为____________.(已知:N2H4+H+![]() N2H5+ 的K=8.7×107;KW =1.0×10-14)
N2H5+ 的K=8.7×107;KW =1.0×10-14)
【答案】 (升高)温度 40% N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.5kJ·mol-1 6.24kJ ![]()
【解析】(1)③到达平衡的时间比①短,到达平衡时N2的浓度高于①,与①相比,平衡向逆反应方向移动,故③与①相比温度升高,即该条件为升高温度;实验②平衡时H2的转化率为α(H2)=![]() ×100%=
×100%=![]() ×100%=40%;(2)①已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量,则1mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出641.5kJ的热量,该反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.5kJ·mol-1;②根据热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol,消耗标准状况下的空气2.24L(假设空气中氧气体积含量为20%)时,即消耗氧气是0.02mol,此燃料电池的能量转化率为50%时,电池产生的电能为624kJ×0.02×50%=6.24kJ;(3)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离的方程式为N2H4+H2O
×100%=40%;(2)①已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量,则1mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出641.5kJ的热量,该反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.5kJ·mol-1;②根据热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol,消耗标准状况下的空气2.24L(假设空气中氧气体积含量为20%)时,即消耗氧气是0.02mol,此燃料电池的能量转化率为50%时,电池产生的电能为624kJ×0.02×50%=6.24kJ;(3)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离的方程式为N2H4+H2O![]() N2H5++OH-,已知:N2H4+H+
N2H5++OH-,已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 。
N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】“优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列行为不符合这个要求的是( )
A. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B. 加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用
C. 研制开发以水代替有机溶剂的化工涂料
D. 将煤转化成气体燃料可以有效地减少“温室效应”气体的产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部曾发布公告:禁止在面粉生产过程中添加过氧化钙(CaO2)等食品添加剂。下列有关过氧化钙(CaO2)的叙述错误的是
A. CaO2具有氧化性,对面粉可能具有增白作用
B. 过氧化钙固体中阴阳离子个数之比为2:1
C. CaO2和CO2反应时,每产生1molO2转移2mol电子
D. CaO2和水反应的化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸钾、硫酸铜、硫酸铝溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为
A. 1:2:3 B. 1:6:9 C. 1:2:1 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
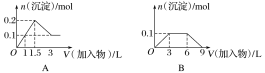
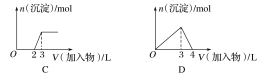
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上常以氨气为原料制备硝酸,其中有一步非常重要的反应为
4NH3+5O2![]() 4NO+6H2O,该反应的氧化剂为______,还原剂为______。用单线桥法表示该氧化还原反应电子转移的方向和数目____________________________________。
4NO+6H2O,该反应的氧化剂为______,还原剂为______。用单线桥法表示该氧化还原反应电子转移的方向和数目____________________________________。
若有标准状况下VL氨气完全反应,并转移n个电子,则阿伏伽德罗常数(NA)可表示为__________________(写出含n、V的表达式)。
(2)某一反应体系中有反应物和生成物共5种物质:S、 H2S、HNO3、NO、H2O。已知硝酸是一种反应物,该反应中还原产物是________;若反应中转移了0.3mol电子,则氧化产物的质量是_____g。
(3)按要求填空:
①除去碳酸氢钠溶液中的碳酸钠______________________(用离子方程式表示原理);
②除去碳酸钠溶液中的碳酸氢钠,应加试剂为________________;
③用氢氧化钡除去明矾溶液中的硫酸根__________________(用离子方程式表示原理)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法。请回答下列问题:
(1)电解精制食盐水,电解槽中的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许阳离子通过,而不允许_____________(填离子符号)和气体通过。

(2)氯碱工业中获得的烧碱可以吸收有毒气体H2S,吸收后的溶液加入到如图所示的电解池的阳极区进行电解以获取单质硫。
①Na2S溶液显碱性的原因(离子方程式):____________________________________________________________。
②电极A应该与直流电源的____________相连。A电极反应为________________________________________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电、节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出。

①图示中电极产物X、Y分别是____________、____________(填化学式)。图示中氢氧化钠溶液质量分数大小:a%______b%(填“﹥”“﹤”或“=”)。
②燃料电池B中正极的电极反应:_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com