
氯气用途十分广泛,可用于生产半导体材料硅,其生产的流程如下,下列说法不正确的是( )石英砂 粗硅
粗硅 四氯化硅
四氯化硅 纯硅.
纯硅.
|
| A. | ①③是置换反应,②是化合反应 |
|
| B. | 高温下,焦炭与氢气的还原性均强于硅 |
|
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 |
|
| D. | 如果焦炭不足,反应①会释放CO2气体 |
| 硅和二氧化硅. | |
| 专题: | 碳族元素. |
| 分析: | A.根据置换反应是一种单质和一种化合物生成另一种单质和化合物;化合反应是两种或两种以上的物质反应只生成一种化合物的反应; B.根据还原剂的还原性大于还原产物的还原性; C.根据质量转化成物质的量以及每消耗或生成1个硅,化合价均变化4,即均转移4个电子; D、无论焦炭是否过量,均生成CO. |
| 解答: | 解:A.二氧化硅与碳反应生成硅和一氧化碳,四氯化硅与氢气反应生成硅和氯化氢,都是置换反应,硅和氯气反应生成四氯化硅,是化合反应,故A正确; B.二氧化硅与碳反应生成硅和一氧化碳,四氯化硅与氢气反应生成硅和氯化氢,根据还原剂的还原性大于还原产物的还原性,则高温下,焦炭与氢气的还原性均强于硅,故B正确; C.28 g硅的物质的量为1mol,每消耗或生成1个硅,化合价均变化4,即均转移4个电子,所以每消耗或生成28 g硅,均转移4 mol电子,故C正确; D、无论焦炭是否过量,均生成CO,不会生成二氧化碳,故D错误. 故选D. |
| 点评: | 本题借助于工业制硅的过程,考查了反应类的判断、还原性的比较、电子转移数目的计算,难度中等. |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g),以下说法正确的是( )
CH3OH(g),以下说法正确的是( )
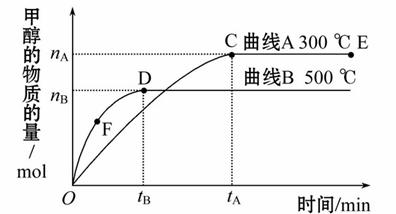
A.E点的平衡常数大于D点的平衡常数,且该反应的ΔH>0
B.容器中气体的总物质的量E点大于D点
C.F点的正反应速率大于逆反应速率
D.v(甲醇)表示500 ℃时以上反应在D点的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为14;X原子的内层电子数与Y原子的最外层电子数相等;X原子的核外电子总数与Z原子的最外层电子数相等。下列说法正确的是( )
A.X的氧化物都能与水反应生成酸
B.Y和Z组成的化合物是离子化合物
C.Z的离子半径比Y的离子半径小
D.X的气态氢化物分子与Z的离子具有相同的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是人们开发利用的一种新能源,已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
③CH3OH(l)===CH3OH(g) ΔH3=+37.4 kJ·mol-1
(1)写出表示甲醇燃烧热的热化学方程式:__________________________________________________________
__________________________________________________________。
(2)H2的燃烧热为__________________________________________________________。
(3)二甲醚也是一种新型燃料,1 mol二甲醚蒸气完全燃烧生成CO2和液态水时放出1 455 kJ热量,若1 mol二甲醚和甲醇的混合气体完全燃烧生成CO2和液态水时共放出1 224.9 kJ热量,则混合气体中甲醇和二甲醚的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积为2 L的密闭容器中,充入1 mol 气体A和a mol气体B,发生如下反应:A(g)+B(g)2C(g)。5 min 后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如图所示。下列叙述正确的是(双选)( )
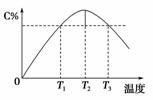
A.0~5 min,C物质的平均反应速率为0.12 mol·L-1·min-1
B.图中T1时正反应速率等于T3时正反应速率
C.该反应T2时的平衡常数大于T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
表中,对陈述Ⅰ、Ⅱ的正确性及两者之间是否具有因果关系判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠可用于治疗胃酸过多 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 将Na2O2投入水中充分反应后,滴入酚酞变红 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发生透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 保存NaOH溶液的试剂瓶用橡皮塞 | NaOH能与玻璃中的SiO2发生反应 | Ⅰ对,Ⅱ对,有 |
|
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列框图中每个字母表示一种反应物或生成物,其中A、B、E为气体,A在B中燃烧时发生苍白色火焰,反应③为实验室制取氧气的常用反应之一.请按下述框图进行推断(其中一部分生成物已略去):
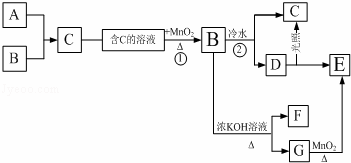
(1)写出A、B、F、G的化学式:
A ;B ;F ;G .
(2)写出反应①的离子反应方程式 .根据框图的先后,两处MnO2的作用依次是 剂、 剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com