
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3,2 | 6.0 | 6.5 | 7 |
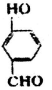 比
比 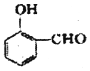 的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”). 分析 (1)①通过离子键结合形成的晶体为离子晶体;原子间通过共价键形成空间网状结构的晶体为原子晶体;
②根据晶体类型不同,以及同种晶体类型影响微粒之间作用力的因素分析表中氟化物熔点差异的原因;
③每个Si原子形成4个共价键,每个O原子形成2个共价键;
④离子晶体中只存在阴阳离子,没有分子;原子晶体中只含有原子;分子晶体的构成微粒为分子;
(2)成分子间氢键熔沸点比形成分子内氢键的熔沸点更高.
解答 解:(1)①MgO中镁离子和氧离子之间通过离子键结合形成离子晶体,SiO2晶体中Si原子与O原子之间通过共价键形成空间网状结构,属于原子晶体;
故答案为:离子晶体、原子晶体;
②NaF与MgF2为离子晶体,SiF4为分子晶体,分子晶体的熔点比离子晶体低,故SiF4的熔点低;离子晶体的熔点与离子中所带电荷以及离子半径有关,Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
③SiO2中每个Si原子形成4个共价键,每个O原子形成2个共价键,所以1mol SiO2中含有4molSi-O键,Si和O原子配位数之比为4:2=2:1;
故答案为:4;2:1;
④NaF、MgF2、MgO都是离子晶体中只存在阴阳离子,没有分子;SiO2是原子晶体只含有原子,没有分子;SiF4是分子晶体,构成微粒为分子;
故答案为:SiF4;
(2)形成分子间氢键熔沸点比形成分子内氢键的熔沸点更高.由表中数据可知,间-羟基苯甲醛形成分子间氢键,邻-羟基苯甲醛形成分子内氢键,故前者沸点高;
故答案为:高.
点评 本题考查了物质结构和性质,题目难度中等,注意从晶体结构和分子结构考虑对物质性质的影响,明确影响晶体熔点因素和氢键等知识是解题的关键,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.
某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C | |
| B. | 三种元素的最高价氧化物对应水化物均可由化合反应得到 | |
| C. | A的氢化物稳定性小于C的氢化物稳定性 | |
| D. | B 和A的最高价氧化物可发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
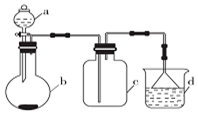 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | NH3 | H3O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石的熔化和冰的融化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com