
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释至1000mL,经测定A溶液的pH大于B溶液的pH。下列判断正确的是 ( )。
A.原溶液中c(A)=c(B)
B.原溶液中c(A)>c(B)
C.若A溶液的pH等于5,则A为强酸,B为弱酸
D.若A溶液和B溶液的pH大于2,小于5,则A、B都为弱酸
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质或结构信息 | 单质常温下为固体,难溶于水易于溶CS2.能形成2种二元含氧酸. | 原子的M层有1个未成对的p电子.核外p电子总数大于7. | 单质曾被称为“银色的金子”.与锂形成的合金常用于航天飞行器.单质能溶强酸和强碱. | 原子核外电子层上s电子总数比p电子总数少2个.单质和氧化物均为空间网状晶体,具有很高的熔、沸点. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 |
| 酸化 |
| NaOH溶液 |
| 酸化 |
| NaOH溶液 |
| 酸化 |


| 实验步骤 | 所用试剂 | 现 象 | 结 论 |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |
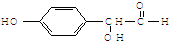

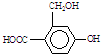 为实现以下物质的转化
为实现以下物质的转化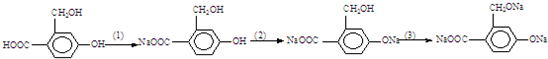
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(08泉州五中模拟)将一定体积的某NaOH溶液分成两等份,一份用pH=a的一元酸HA溶液中和,另一份用pH=b的一元酸HB溶液中和,结果消耗两种酸溶液体积相等,则下列叙述一定正确的是( )
A.若a>b,则说明相同浓度时,酸性HA>HB
B.若a=b,两种酸的浓度c(HA)、c(HB)可能不同
C.若a<b,则所得溶液的pH值为:pH(NaA)<pH(NaB)
D.若所得盐溶液中:c(A―)>c(B―),则a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com