
【题目】下列有关物质用途的说法中,不正确的是
A. 氢氟酸可用来刻蚀玻瑞 B. 过氧化钠常用作供氧剂
C. 漂白粉可用作游泳池的消毒剂 D. 晶体硅可用于制作光导纤维
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】往下列溶液中加入足量NaOH溶液,充分反应后,不会出现沉淀的是( )
A. MgCl2溶液 B. AlCl3溶液 C. CaCl2溶液 D. FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A | 除去KCl中的MnO2 | 蒸发结晶 | 溶解度不同 |
B | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
C | 分离KNO3和NaCl | 重结晶 | KN03的溶解度大于NaCl |
D | 除去碘中的NaCl | 加热、升华 | NaCl的熔点高,碘易升华 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用10mL 0.1mol/L的BaCl2溶液分别和相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液反应,均恰好使三份溶液中的SO42-离子完全转化为BaSO4沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A. 3∶2∶2 B. 1∶2∶3 C. 3∶1∶1 D. 1∶3∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钡是白色的晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,需密封保存。工业上制备BaCl2·2H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:

(1)写出“溶解”时反应的化学方程式方程式:________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_____________。
(3)结晶得到的晶体,需用乙醇洗涤的理由是_______________________。
途径2:以毒重石(主要成分BaCO3,含CaCO3、MgCO3、Fe2O3、SiO2等杂质)为原料,流程如下:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,Ksp[Mg(OH)2]=1.8×10-11。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(4)滤渣I的成分为________(填化学式)。
(5)滤渣II中含_________(填化学式)。过滤析出后,滤液中含有的Mg2+浓度为_______。
(6)加入H2C2O4时应避免过量,其原因是为了防止生成______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活及生产过程直接排放的超细颗粒物是大气中可吸入颗粒物的主要来源。能减少大气中可吸入颗粒物的措施有( )
A. 加高工厂烟囱 B. 推广使用新能源汽车
C. 安装除尘设备 D. 将高污染产业转型升级
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第ⅦA族元素性质特征的是( )
A. 从上到下元素的非金属性增强 B. 易形成-1价离子
C. 最高价氧化物的水化物显酸性(氟除外) D. 从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定。
反应原理为:2S2O32+I2=S4O62-+2I
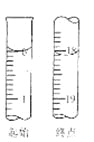
(5)滴定至终点时,溶液颜色的变化: 。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42,常用作脱氧剂,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是

A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com