
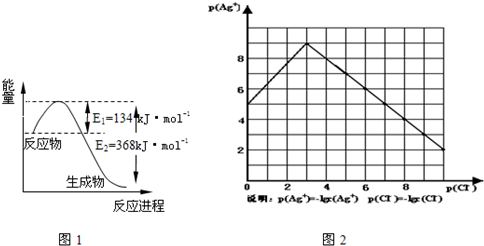
 2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
 N2(g)+3H2(g)的化学平衡常数的值为 。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __ v(N2)逆(填写“>”、“=”或“<”=)
N2(g)+3H2(g)的化学平衡常数的值为 。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __ v(N2)逆(填写“>”、“=”或“<”=) CO2(g)+NO(g);△H=-234kJ/mol (2) ① > ② c ③ 2 >
CO2(g)+NO(g);△H=-234kJ/mol (2) ① > ② c ③ 2 > CO2(g)+NO(g);△H=-234kJ/mol 。(2) ①升高温度化学平衡向吸热反应方向移动。由于该反应的正反应是放热反应。所以升高温度化学平衡向逆反应方向移动。平衡越向逆反应方向移动,反应的平衡常数就越小。所以K1 >K2。②a平衡时各物质的浓度与起始加入的物质的多少有关。只要平衡时各种物质的浓度不变,反应就达到了平衡。错误。b.在任何时刻都有3v(N2)正=v(H2)正,而v(N2)正=3v(H2)逆,代入第一个式子可得9 v(H2)逆= v(H2)正。由于V(H2)正>V(H2)逆。反应未达到平衡。错误。c.由于容器的容积不变,若反应达到平衡,各种物质的物质的量不变,容器内压强也保持不变 。正确。 d.反应无论进行到什么程度,质量都不会发生变化,那么任何时刻混合气体的密度都保持不变。所以不能根据容器的容积不变来判断反应达到平衡。错误。选项为:C. ③400℃时,2NH3(g)
CO2(g)+NO(g);△H=-234kJ/mol 。(2) ①升高温度化学平衡向吸热反应方向移动。由于该反应的正反应是放热反应。所以升高温度化学平衡向逆反应方向移动。平衡越向逆反应方向移动,反应的平衡常数就越小。所以K1 >K2。②a平衡时各物质的浓度与起始加入的物质的多少有关。只要平衡时各种物质的浓度不变,反应就达到了平衡。错误。b.在任何时刻都有3v(N2)正=v(H2)正,而v(N2)正=3v(H2)逆,代入第一个式子可得9 v(H2)逆= v(H2)正。由于V(H2)正>V(H2)逆。反应未达到平衡。错误。c.由于容器的容积不变,若反应达到平衡,各种物质的物质的量不变,容器内压强也保持不变 。正确。 d.反应无论进行到什么程度,质量都不会发生变化,那么任何时刻混合气体的密度都保持不变。所以不能根据容器的容积不变来判断反应达到平衡。错误。选项为:C. ③400℃时,2NH3(g)  N2(g)+3H2(g)的化学平衡常数和反应N2(g)+3H2(g)
N2(g)+3H2(g)的化学平衡常数和反应N2(g)+3H2(g)  2NH3(g)的化学平衡常数互为倒数。即为2,。由于C2(NH3)/C(N2)C3(H2)=62/(4×23)=9/8<2.所以反应向正反应方向移动。即V(N2)正> V(N2)逆。
2NH3(g)的化学平衡常数互为倒数。即为2,。由于C2(NH3)/C(N2)C3(H2)=62/(4×23)=9/8<2.所以反应向正反应方向移动。即V(N2)正> V(N2)逆。

科目:高中化学 来源:不详 题型:填空题

| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸碱中和是放热反应 |
| B.炭在二氧化碳气体中灼烧发生的反应属于放热反应 |
| C.原子间形成化学键时需吸收能量 |
| D.化学反应过程中,化学能一定全部转化成热能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) △H=— 92.4kJ?mo1—1,下列结论正确的是
2NH3(g) △H=— 92.4kJ?mo1—1,下列结论正确的是| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g) 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H1=△H2 | B.△H2>△H1 |
| C.△H3>△H2 | D.△H1>△H3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com