
| A£® | Ź¢ÓŠSO2µÄĆܱÕČŻĘ÷ÖŠŗ¬ÓŠNAøöŃõŌ×Ó£¬ŌņSO2µÄĪļÖŹµÄĮæĪŖ0.5 mol | |
| B£® | 28gŅŅĻ©ŗĶ»·±ūĶé£ØC3H6£©×é³ÉµÄ»ģŗĻĘųĢ壬ĶźČ«Č¼ÉÕŹ±£¬×ŖŅʵĵē×ÓŹżĪŖ12NA | |
| C£® | 0.1 mol•L-1µÄ£ØNH4£©2SO4ČÜŅŗÖŠ£¬Ėłŗ¬NH4+ŹżŠ”ÓŚ0.2NA | |
| D£® | ±ź×¼×“æöĻĀ£¬2.24 L18O2ÖŠŗ¬ÓŠ2NAøöÖŠ×Ó |
·ÖĪö A£®Ņ»øöSO2ÖŠŗ¬ÓŠ2øöŃõŌ×Ó£»
B£®ŅŅĻ©Óė»·±ūĶé¾ßÓŠĻąĶ¬×ī¼ņŹ½CH2£¬1molCH2ĶźČ«Č¼ÉÕĻūŗÄ1.5molŃõĘų£¬×ŖŅĘ1.5mol”Į4=6molµē×Ó£»
C£®ČÜŅŗĢå»żĪ“ÖŖ£»
D.1øö18O2ÖŠŗ¬ÓŠ20øöÖŠ×Ó£®
½ā“š ½ā£ŗA£®Ņ»øöSO2ÖŠŗ¬ÓŠ2øöŃõŌ×Ó£¬Ź¢ÓŠSO2µÄĆܱÕČŻĘ÷ÖŠŗ¬ÓŠNAøöŃõŌ×Ó£¬ŌņSO2µÄĪļÖŹµÄĮæĪŖ0.5mol£¬¹ŹAÕżČ·£»
B.28gŅŅĻ©ŗĶ»·±ūĶé£ØC3H6£©×é³ÉµÄ»ģŗĻĘųĢ壬ŗ¬ÓŠCH2ĪļÖŹµÄĮæĪŖ$\frac{28g}{14g/mol}$=2mol£¬ĶźČ«Č¼ÉÕŹ±£¬ĻūŗÄ3molŃõĘų£¬×ŖŅʵĵē×ÓŹżĪŖ12NA£¬¹ŹBÕżČ·£»
C£®ČÜŅŗĢå»żĪ“ÖŖ£¬ĪŽ·ØČ·¶Ø°±øłĄė×ÓøöŹż£¬¹ŹC“ķĪó£»
D£®±ź×¼×“æöĻĀ£¬2.24 L18O2ÖŠŗ¬ÓŠ$\frac{2.24L}{22.4L/mol}”Į$ 20”ĮNA=2NAøöÖŠ×Ó£¬¹ŹDÕżČ·£»
¹ŹŃ”£ŗC£®
µćĘĄ ±¾Ģā漲鰢·ü¼ÓµĀĀŽ³£ŹżµÄÓ¦ÓĆ£¬ÕĘĪÕŅŌĪļÖŹµÄĮæĪŖŗĖŠÄ¼ĘĖć¹«Ź½£¬Ć÷Č·ĪļÖŹµÄ×é³É”¢½į¹¹”¢ŠŌÖŹŅŌ¼°ĪļÖŹ“ęŌŚµÄĶā½ēĢõ¼žŗĶ¾Ū¼ÆדĢ¬µČĪŹĢāŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
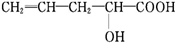 ŌŚ²»Ķ¬Ģõ¼žĻĀÖĮÉŁæÉÄÜ·¢ÉśĮłÖÖ²»Ķ¬ĄąŠĶµÄÓŠ»ś·“Ó¦£ŗ¢Ł¼Ó³É£»¢ŚČ”“ś£»¢ŪĻūČ„£»¢ÜŃõ»Æ£»¢Żõ„»Æ£»¢Ž¼Ó¾Ū£®ĘäÖŠÓÉÓŚ·Ö×Ó½į¹¹ÖŠŗ¬-OHæÉÄÜ·¢ÉśµÄ·“Ó¦ÓŠ£Ø””””£©
ŌŚ²»Ķ¬Ģõ¼žĻĀÖĮÉŁæÉÄÜ·¢ÉśĮłÖÖ²»Ķ¬ĄąŠĶµÄÓŠ»ś·“Ó¦£ŗ¢Ł¼Ó³É£»¢ŚČ”“ś£»¢ŪĻūČ„£»¢ÜŃõ»Æ£»¢Żõ„»Æ£»¢Ž¼Ó¾Ū£®ĘäÖŠÓÉÓŚ·Ö×Ó½į¹¹ÖŠŗ¬-OHæÉÄÜ·¢ÉśµÄ·“Ó¦ÓŠ£Ø””””£©| A£® | ¢Ł¢Ü¢Ž | B£® | ¢Ū¢Ü¢Ż¢Ž | C£® | ¢Ś¢Ū¢Ü¢Ż | D£® | ¢Ł¢Ś¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
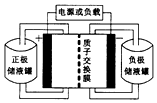 Ņ»ÖÖ·°-¶ąĀ±»ÆĪļµē³Ų½į¹¹Ź¾ŅāĶ¼ČēĶ¼ĖłŹ¾£¬µē³ŲŗĶ“¢Ņŗ¹Ž¾ł“ę“¢ÓŠ·“Ó¦ĪļŗĶĖįŠŌµē½āÖŹČÜŅŗ£®µē³ŲÖŠ·¢ÉśµÄ·“Ó¦ĪŖ2VCl2+BrCl${\;}_{2}^{-}$$?_{·Åµē}^{³äµē}$2VCl3+Br-ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
Ņ»ÖÖ·°-¶ąĀ±»ÆĪļµē³Ų½į¹¹Ź¾ŅāĶ¼ČēĶ¼ĖłŹ¾£¬µē³ŲŗĶ“¢Ņŗ¹Ž¾ł“ę“¢ÓŠ·“Ó¦ĪļŗĶĖįŠŌµē½āÖŹČÜŅŗ£®µē³ŲÖŠ·¢ÉśµÄ·“Ó¦ĪŖ2VCl2+BrCl${\;}_{2}^{-}$$?_{·Åµē}^{³äµē}$2VCl3+Br-ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | VCl2“ę“¢ŌŚÕż¼«“¢Ņŗ¹ŽÄŚ | |
| B£® | ·ÅµēŹ±H+“Óøŗ¼«ĒųŅĘÖĮÕż¼«Ēų | |
| C£® | ³äµēŹ±µē³ŲµÄøŗ¼«ÓėµēŌ“µÄÕż¼«ĻąĮ¬ | |
| D£® | ³äµēŹ±Ńō¼«·“Ó¦ĪŖBr-+2Cl--2e-ØTBrCl2- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
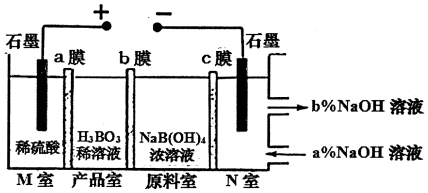
| A£® | MŹŅ·¢ÉśµÄµē¼«·“Ó¦Ź½£ŗ2H2O-4e-ØTO2”ü+4H+ | |
| B£® | NŹŅ£ŗa%£¼b% | |
| C£® | ²śĘ·ŹŅ·¢ÉśµÄ·“Ó¦ŹĒ£ŗB£ØOH£©4-+H+?H3BO3+H2O | |
| D£® | ĄķĀŪÉĻĆæÉś³É1mol²śĘ·£¬Ņõ¼«ŹŅæÉÉś³É±ź×¼×“æöĻĀ5.6LĘųĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
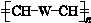 £ØWŹĒĮ“½ŚÖŠµÄ²æ·Ö½į¹¹£©ŹĒŅ»ĄąÖŲŅŖµÄ¹¦ÄÜøß·Ö×Ó²ÄĮĻ£®¾ŪŗĻĪļ XŹĒĘäÖŠµÄŅ»ÖÖ£¬×Ŗ»ÆĀ·ĻßČēĶ¼£ŗ
£ØWŹĒĮ“½ŚÖŠµÄ²æ·Ö½į¹¹£©ŹĒŅ»ĄąÖŲŅŖµÄ¹¦ÄÜøß·Ö×Ó²ÄĮĻ£®¾ŪŗĻĪļ XŹĒĘäÖŠµÄŅ»ÖÖ£¬×Ŗ»ÆĀ·ĻßČēĶ¼£ŗ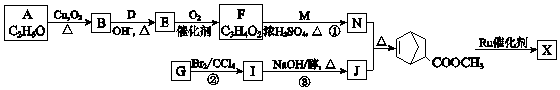
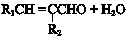
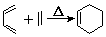
 +2NaOH$”ś_{”÷}^{“¼}$
+2NaOH$”ś_{”÷}^{“¼}$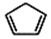 +2 NaBr+2 H2O£®
+2 NaBr+2 H2O£®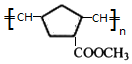 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2O2µÄµē×ÓŹ½£ŗ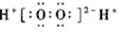 | B£® | CCl4µÄµē×ÓŹ½£ŗ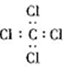 | ||
| C£® | ${\;}_{\;}^{18}$OµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼£ŗ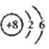 | D£® | MgCl2µÄµē×ÓŹ½£ŗ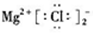 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
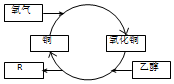
| A£® | RµÄ»ÆѧŹ½ĪŖC2H4O | |
| B£® | ŅŅ“¼·¢ÉśĮĖ»¹Ō·“Ó¦ | |
| C£® | ·“Ó¦¹ż³ĢÖŠ¹ĢĢåÓŠŗģŗŚ½»Ģę±ä»ÆµÄĻÖĻó | |
| D£® | ŅŅ¶ž“¼£ØHO-CH2-CH2-OH£©Ņ²ÄÜ·¢ÉśĄąĖĘ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com