
在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO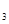 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
(5分)(1)固体表面积(2)催化剂(3)物质的性质(4)溶液的浓度(5)温度
解析试题分析:可以根据影响化学反应速率的因素方面进行分析、判断,从而得出正确的结论。
(1)黄铁矿煅烧时要粉碎成细小的矿粒,可以增大反应物的接触面积,加快反应速率。
(2)熔化的氯酸钾放出气泡很慢,若加入少量Mn02时分解加速,说明化学反应速率受催化剂的影响。
(3)同浓度、同体积的盐酸中放入同样大小的碳粒和镁条,产生气体有快有慢,这说明影响化学反应速率的因素是反应物自身的性质。
(4)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同,这是由于盐酸的浓度不同引起的,反应物的浓度越大,反应速率越快。
(5)夏天的食品易霉变,冬天就不易发生该现象,这是由于夏天气温高,故食品易霉变,而冬天气温低不易发生该现象,因此温度高低对反应速率有影响,温度越高反应速率越快。
考点:考查外界条件对化学反应速率的影响
点评:该题是基础性试题的考查,难度不大。明确反应速率的含义以及影响因素是答题的关键。因此解答本题时要充分理解影响化学反应速率的因素,然后才能对问题做出正确的判断。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:填空题
(6分)已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g) C(g),平衡时C 的体积分数为40℅。
C(g),平衡时C 的体积分数为40℅。
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 。
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40℅,则该密闭容器体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: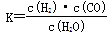 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目 。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为 。
(3)Fe3+的电子排布式为 ;CH3+微粒的中心原子杂化轨道类型为 ;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡 (用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象 。(不考虑SCN—与Mg2+反应)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据反应:mA(g) + nB(g) pC(g) △H,结合图中所给的信息填空。
pC(g) △H,结合图中所给的信息填空。
(填“>”、“=”或“<”)
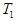 ______
______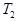
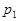 ______
______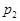
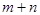 ______
______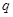
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一体积为10 L的容器中,通过一定量的CO和H2O,850 ℃时发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)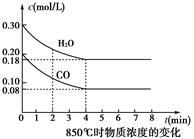
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=______mol·L-1·min-1。
(2)如图中4~5min之间该反应________(填“是”或“否”)处于平衡状态,判断理由________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|

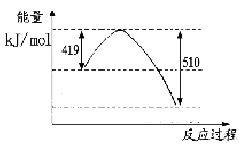 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(12分)在一容积为2L的密闭容器中加入2molA和6molB,保持温度为20℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)  2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
⑴求20℃时,该反应的平衡常数K(保留三位有效数字)
⑵20℃时,若在同一容器中加入1molA、 mol B和 mol C,则平衡混合气中C的体积分数仍为ω。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com