
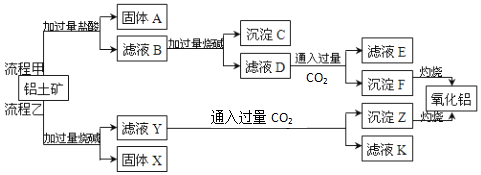
分析 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料,
流程甲:向铝土矿中加入过量稀盐酸,发生的反应为Fe2O3+6HCl=2FeCl3+3H2O、Al2O3+6HCl=2AlCl3+3H2O,MgO+2HCl=MgCl2+H2O,二氧化硅不反应,所以固体A为SiO2,滤液中溶质为FeCl3、AlCl3、MgCl2、HCl,向滤液B中加入过量NaOH,发生的反应为FeCl3+3NaOH=3NaCl+Fe(OH)3↓、AlCl3+4NaOH=3NaCl+NaAlO2+2H2O、MgCl2+2NaOH=2NaCl+Mg(OH)2↓、HCl+NaOH=NaCl+H2O,所以沉淀C是Fe(OH)3、Mg(OH)2,滤液D中溶质为NaCl、NaAlO2、NaOH,向溶液中通入过量二氧化碳,发生的反应为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3、NaOH+CO2=NaHCO3,所以沉淀F为Al(OH)3,滤液E中溶质为NaHCO3,灼烧沉淀F发生的化学反应方程式为2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O;
向铝土矿中加入过量烧碱溶液,发生的反应为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,氧化铁、氧化镁不反应,所以固体X为Fe2O3、MgO,滤液Y中成分为NaAlO2、Na2SiO3、NaOH,通入过量二氧化碳时,发生的反应为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3、NaOH+CO2=NaHCO3、Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓,所以沉淀Z为Al(OH)3、H2SiO3,滤液K中溶质为NaHCO3,灼烧沉淀Z得到氧化铝,据此分析解答.
解答 解:(1)①向铝土矿中加入过量烧碱溶液,发生的反应为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,氧化铁、氧化镁不反应,所以固体X为Fe2O3、MgO;
故答案为:Fe2O3、MgO;
②固体A为SiO2,可用于制玻璃、陶瓷、水泥、光导纤维等;用SiO2制粗硅的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
故答案为:制玻璃、陶瓷、水泥、光导纤光导纤维等;SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
③滤液D中溶质为NaCl、NaAlO2、NaOH,向溶液中通入过量二氧化碳,含铝化合物与其反应的离子方程式为2H2O+AlO2-+CO2=Al(OH)3↓+HCO3-;
故答案为:2H2O+AlO2-+CO2=Al(OH)3↓+HCO3-;
④工业上常用石墨作阳极电解氧化铝制铝,电解过程中,需要不断补充阳极材料,原因是阳极产生的氧气在高温下易与石墨反应从而不断消耗阳极材料;
故答案为:阳极产生的氧气在高温下易与石墨反应从而不断消耗阳极材料;
(2 )电镀过程中不产生其他离子且有机阳离子不参与电极反应,则阴极反应生成铝是发生的还原反应,铝元素化合价降低,分析离子液体成分,结合电荷守恒分析可知是Al2Cl7-得到电子生成,电极反应为:4Al2Cl7-+3e-=Al+7AlCl4-;
故答案为:4Al2Cl7-+3e-=7AlCl4-+Al;
(3)比较上述制备氧化铝的甲、乙两流程:流程甲所用试剂较乙多且操作较繁琐,但生成的Al2O3纯度高;流程乙所得Al2O3产率较甲高(含少量SiO2)但纯度低;
故答案为:流程甲所用试剂较乙多且操作较繁琐,但生成的Al2O3纯度高,流程乙所得Al2O3产率较甲高(含少量SiO2)但纯度低.
点评 本题考查物质分离和提纯的综合应用,为高频考点,明确流程图中发生的反应及物质性质是解本题关键,难点是正确书写离子方程式、各滤液成分的判断,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
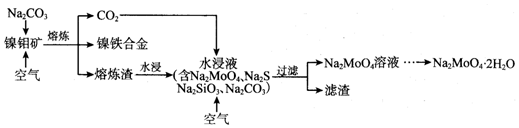

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的CH3COOH溶液中,由水电离出来的c(H+)=1.0×10-4mol•L-1 | |
| B. | 物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中c(NH4)+:①<② | |
| C. | pH=3的0.1mol•L-1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
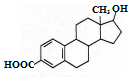
| A. | 该有机物的分子式为C19H22O3 | |
| B. | 该分子中所有碳原子不可能在同一个平面内 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 能与Na、NaOH溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
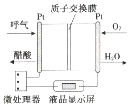
| A. | 电流由呼气所在的铂电极流出 | |
| B. | H+透过质子交换膜流向氧气所在的铂电极 | |
| C. | 电路中流过2mol电子时,消耗11.2LO2 | |
| D. | 该电池的负极反应为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com