
| A.饱和氯水中 Cl-、NO3-、Na+、SO32- | B.强酸性的溶液中 C6H5O-、K+、SO42-、Br- |
| C.Na2S溶液中 SO42-、K+、Cl-、Cu2+ | D.强碱性的溶液中 NO3-、I-、Na+、AlO2- |
科目:高中化学 来源:不详 题型:单选题
| A.Na+ 、H+、SO42-、HCO3- |
| B.Cu2+、SO42-、Ba2+、Cl- |
| C.Na+、 K+、Cl-、 NO3- |
| D.Fe2+、NO3-、Cl-、H+、 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl→H2SO4→H2S→NaOH→CO2 |
| B.NaCl→Na2SO4→NaOH→H2S→CO2 |
| C.Na2S→Na2SO4→NaCl→NaOH→CO2 |
| D.Na2SO4→HCl→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、Ca2+、ClO—、CH3COO— | B.Fe3+、NH+4、SCN-、NO—3 |
| C.H3O+、NO—3、Fe3+、Na+ | D.Al3+、K+、SO2-4、HCO—3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、MnO4-、K+、NO3-、SO32- | B.Na+、S2-、SO32-、H+、、NO3- |
| C.Na+、S2-、OH-、K+、Cl- | D.HCO3-、H+、Na+、Ca2+、SO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.饱和氯水中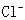 、 、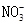 、 、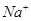 、 、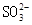 |
B.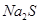 溶液中 溶液中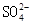 、 、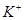 、 、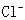 、Fe3+ 、Fe3+ |
C.pH=13的溶液中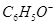 、 、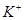 、 、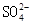 、 、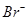 |
D.由水电离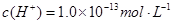 溶液中 溶液中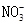 、 、 、 、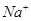 、 、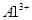 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(CH3COO-):③>① |
| B.水电离出的c(OH-):②>① |
| C.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) |
| D.①和③无论以何种比例混合,混合后的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
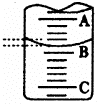
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com