
| A. | 石油分馏 | B. | 煤的干馏 | C. | 海水制镁 | D. | 海带提碘 |
分析 物理变化没有新物质生成,化学变化有新物质生成,据此解答.
解答 解:A.蒸馏是利用物质沸点不同而分离物质的方法,过程中没有新物质生成,属于物理变化,故A选;
B.煤的干馏是隔绝空气加强热使煤分解的过程中,有新物质生成,该过程既有物理变化又有化学变化,故B不选;
C.海水制镁过程中,镁元素从化合态转变为游离态的镁单质,发生氧化还原反应,存在化学变化,故C不选;
D.海带提碘过程中,碘元素从化合态转变为游离态的碘单质,发生氧化还原反应,存在化学变化,故D不选;
故选:A.
点评 本题考查了物理变化与化学变化的区别,明确石油分馏、煤的干馏、海水提镁、海水提溴的原理是解题关键,提镁难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向含有等物质的量的Ba(OH)2、KOH的混合溶液中通入CO2,与CO2反应的物质依次是:KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+的混合溶液中加入Zn,与Zn反应的离子依次是:Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2-、OH-、CO32-的混合溶液中滴加盐酸,与盐酸反应的物质依次是:AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气,与氯气反应的离子依次是:I-、Br-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
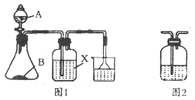 某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:
某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
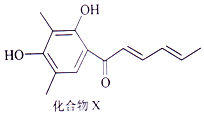 Sorbicillin (简称化合物X)是生产青霉素时的一个副产品,其结构简式如图所示. 下列有关化合物X的说法正确的是( )
Sorbicillin (简称化合物X)是生产青霉素时的一个副产品,其结构简式如图所示. 下列有关化合物X的说法正确的是( )| A. | 分子中所有碳原子可能处于同一平面 | |
| B. | 1 mol化合物X可以与2 mol Na2CO3反应 | |
| C. | 1mol化合物X可以与浓溴水发生取代反应消耗3molBr2 | |
| D. | 化合物X与H2完全加成,每个产物分子中含有4个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3•H2O | |
| C. | 氯化铝溶液中滴入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+ | |
| D. | 实验室制取氯气:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳铵--NH4HCO3 | B. | 生石灰 Ca(OH)2 | C. | 石膏--CaSO3 | D. | 酒精 CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4是还原剂 | B. | HC1是氧化剂 | ||
| C. | HC1中的氯元素得到电子 | D. | KMnO4中的Mn元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$\stackrel{O_{2}点燃}{→}$NO2$\stackrel{H_{2}O}{→}$HNO2 | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
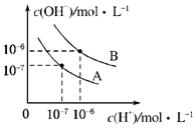 已知水在不同温度下的电离平衡曲线如图所示.(注:以下溶液混合时均不考虑体积的变化)
已知水在不同温度下的电离平衡曲线如图所示.(注:以下溶液混合时均不考虑体积的变化)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com