
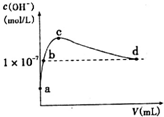
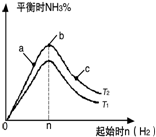
 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
分析 A.a点溶液中的溶质是NaOH,水电离出的c(H+)=10-pH;
B.常温下,c(OH-)=1×10-7mol/L,溶液呈中性;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子但程度较小;
D.d点溶液中,溶液呈中性,溶液中存在电荷守恒,根据电荷守恒判断.
解答 解:A.a点溶液中的溶质是NaOH,水电离出的c(H+)=10-pH=1×10-10mol•L-1,故A正确;
B.常温下,c(OH-)=1×10-7mol/L,溶液呈中性,则c(OH-)=c(H+),所以c(H+)=1×10-7mol•L-1,故B正确;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子但程度较小,所以离子浓度大小顺序是c(Na+)>c(CO32-)>c(HCO3-),故C错误;
D.d点溶液中,溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒得c(Na+)=2c(CO32-)+c(HCO3-),故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,结合电荷守恒进行解答,注意计算碱性溶液中水电离出氢离子和氢氧根离子的方法.


科目:高中化学 来源: 题型:解答题
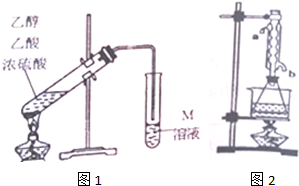
| 相对分子质量 | 沸点(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
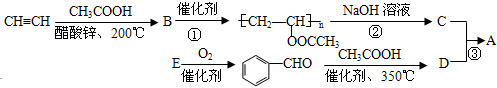
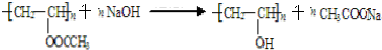 ;反应类型是取代反应.
;反应类型是取代反应. .
.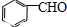 能发生银镜反应,该反应的化学方程式是
能发生银镜反应,该反应的化学方程式是 .
.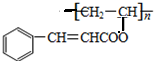 ,关于A的性质下列说法正确的是acd(填字母).
,关于A的性质下列说法正确的是acd(填字母).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
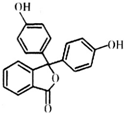 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 能发生加聚反应生成高分子化合物 | |
| C. | 酚酞的水解产物中含有醇羟基 | |
| D. | 1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O2是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | ${\;}_{8}^{18}$O2是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”可以生产“生物燃料”,生物燃料本质上能量来源于太阳能 | |
| B. | 消除水体中的HgCl2污染可利用微生物使其转化为有机汞CH3HgCl | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,但可以加强胃肠蠕动,有助于消化,因此纤维素是人类的营养食物 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是经提纯的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
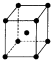 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com