
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| C. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
分析 A.相对分子质量在10000以上的有机化合物为高分子化合物,高分子化合物分为天然高分子化合物、合成高分子化合物;
B.微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石;
C.霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体;
D.沸点低加热易燃烧,水浴加热的温度较低.
解答 解:A.蛋白质、棉花、淀粉都相对分子质量在10000以上,属于天然高分子化合物,故A正确;
B.把不溶性的硫化铜氧化,硫从负二价被氧化成正六价,故最后转化成可溶的硫酸铜,故B错误;
C.霾是由悬浮在大气中的大量微小尘粒、烟粒等直径小于2.5μm的颗粒物形成的,这些污染物称为PM2.5,故C正确;
D.水浴加热的温度较低,则一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低极易被引燃,加热时最好用水浴加热,故D正确.
故选B.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
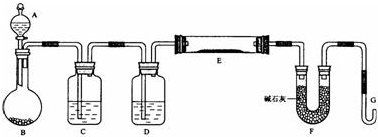
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
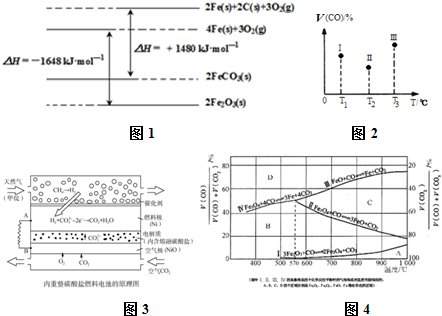
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O和CS2分子中的原子都达到稳定结构.
H2O和CS2分子中的原子都达到稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
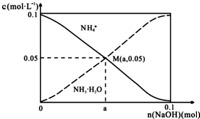 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
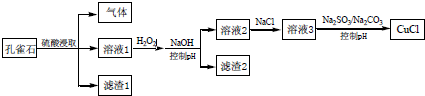
| A. | H2O2 将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去 | |
| B. | CO32-作用是控制溶液pH,促使CuCl 沉淀的生成 | |
| C. | SO32-将溶液3 中的Cu2+还原,反应得到CuCl | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量$\frac{S{O}_{3}^{2-}}{C{O}_{3}^{2-}}$的溶液中,同样可制取CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应SiO2+4HF═SiF4+2H2O,可知SiO2是碱性氧化物 | |
| B. | 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br- | |
| C. | 由反应CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04 | |
| D. | 由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用电池外壳的金属材料 | |
| B. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗泄的电解液腐蚀其他物品 | |
| D. | 回收其中石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com