
下列实验问题的处理方法中,正确的是
A.蔗糖溶液加入稀硫酸共热后,加入银氨溶液,水浴加热,检验水解产物具有还原性
B.在气体发生装置上直接点燃甲烷时,必须先检验甲烷的纯度
C.不慎将苯酚溶液沾到皮肤上,要立即用强碱溶液冲洗
D.为提纯蛋白质,可向鸡蛋清溶液中加入醋酸铅溶液,然后将所得沉淀滤出重新溶于水,即得较纯的蛋白质溶液
B
【解析】
试题分析:银镜反应需要在碱性条件下进行,因此蔗糖水解之后,首先要加入氢氧化钠溶液中和硫酸,然后再进行银镜反应,A不正确;甲烷是可燃性气体,点燃之前需要检验纯度,B正确;C不正确,氢氧化钠检验腐蚀性,应该用酒精洗涤;D中醋酸铅是重金属盐,能使蛋白质变性,不能用来提纯蛋白质,D不正确,答案选B。
考点:考查化学实验基本操作的有关判断
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解
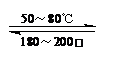 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H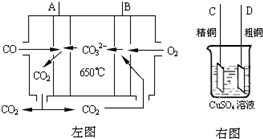
| 10 |
| 11 |
| ||
| 氢离子 |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 ▲ 极 (填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2011届浙江省金华一中高三高考模拟考试(理综)化学部分 题型:填空题
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)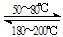 Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与▲ 极(填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。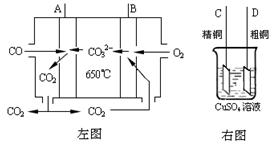
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+ Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42-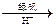 Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三高考模拟考试(理综)化学部分 题型:填空题
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
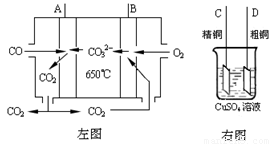
Ni(s)+4CO(g)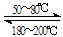 Ni(CO)4(g) 该反应的ΔH
▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH
▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 ▲ 极 (填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42-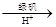 Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2011年浙江省金华一中高考化学模拟试卷(解析版) 题型:解答题
 转化为Cr2O72-.又知:常温时该反应的平衡常数K=1014.上述酸化后所得溶液的pH=______.
转化为Cr2O72-.又知:常温时该反应的平衡常数K=1014.上述酸化后所得溶液的pH=______. Cr3+
Cr3+ Cr(OH)3.用该方法处理10m3 CrO42-的物质的量浓度为1.0×10-3 mol?L-1的废水,至少需要绿矾______Kg(保留两位小数).
Cr(OH)3.用该方法处理10m3 CrO42-的物质的量浓度为1.0×10-3 mol?L-1的废水,至少需要绿矾______Kg(保留两位小数).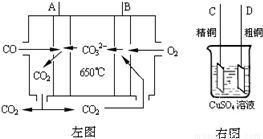
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com