
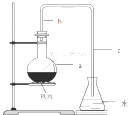
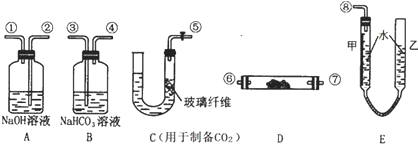
 ��ѧʵ��������ͼ��ʾװ����ȡ�����屽������д���пհף�
��ѧʵ��������ͼ��ʾװ����ȡ�����屽������д���пհף�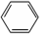 +Br2$\stackrel{FeBr_{3}}{��}$
+Br2$\stackrel{FeBr_{3}}{��}$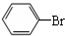 +HBr��
+HBr�� ���� ��1���������ӷ�������b�������⣬�����������������ã����ٱ������ӷ���
��2��HBr��������ˮ���ʽ�HBrͨ��C�е�ˮ��ʱ��������ˮ�����ڿ������γɰ�����
��3����������Һ�еμ�AgNO3��Һʱ�ܲ����廯������ɫ������
��4�����屽Ϊ��ɫҺ�壬�ܶȱ�ˮ���屽����δ��Ӧ���壬���ʺ�ɫ��
��5���ڴ����������£������ϵ���ԭ�ӱ���ԭ����ȡ���������屽��ͬʱ���廯�����ɣ�
��� �⣺��1���������ӷ�������b�������⣬�����������������ã����ٱ������ӷ���
�ʴ�Ϊ������������
��2����Ӧ�������ڵ���c���¿ڸ������Թ۲쵽�������֣��������ڷ�Ӧ���ɵ�HBr��HBr��������ˮ��������ˮ�����ڿ������γɰ�������Ӧ�������ڵ���c���¿ڸ������Թ۲쵽�������֣��������ڷ�Ӧ���ɵ�HBr��
�ʴ�Ϊ��HBr��
��3��HBr��������ˮ�����������Һ���μ�AgNO3��Һʱ�ܲ����廯������ɫ������Ag++Br-=AgBr����
�ʴ�Ϊ���廯������ɫ������
��4�����屽Ϊ��ɫҺ�壬�ܶȱ�ˮ���屽����δ��Ӧ���壬���ʺ�ɫ����Ӧ��Ϻ���ƿa�е�Һ�嵹��ʢ����ˮ���ձ�����Թ۲쵽�ձ��ײ��к�ɫ������ˮ��Һ�壮�����ܽ����嵥�ʵ�ԭ��
�ʴ�Ϊ���֣��壻
��5���ڴ����������£������ϵ���ԭ�ӱ���ԭ����ȡ���������屽��ͬʱ���廯�����ɣ���Ӧ����ʽΪ�� +Br2$\stackrel{FeBr_{3}}{��}$
+Br2$\stackrel{FeBr_{3}}{��}$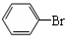 +HBr���ʴ�Ϊ��
+HBr���ʴ�Ϊ�� +Br2$\stackrel{FeBr_{3}}{��}$
+Br2$\stackrel{FeBr_{3}}{��}$ +HBr��
+HBr��
���� �����Ա������ʼ����ӵļ���Ϊ���壬����ѧ����˼ά����������ʵ����������ȣ��Ƕ�֪ʶ���ۺ����ã�����ʵ��ԭ���ǽ��Ĺؼ�����Ŀ�Ѷ��еȣ�


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 56gFe�����������ᷴӦ��ת�Ƶĵ�����Ϊ2NA | |
| B�� | ��״���£�22.4L��ˮ�к��е�ԭ����Ϊ3NA | |
| C�� | ���ʵ���Ũ��Ϊ2mol/L��BaCl2��Һ�У�����Cl-����Ϊ4NA | |
| D�� | 22.4 L CO��CO2�Ļ��������������̼ԭ����һ����NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ����ͼ֪��ʯīת��Ϊ���ʯ�Ƿ��ȷ�Ӧ | |
| B�� |  ����ͼ֪��S��g��+O2��g���TSO2��g����H1��S��s��+O2��g���TSO2��g����H2���H1����H2 | |
| C�� |  ����ͼ֪�����ױȺ����ȶ� | |
| D�� |  ����ͼ֪��CO��g��+H2O��g���TCO2��g��+H2��g����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | N��O | Cl-Cl | Cl-N | N=O |
| ����/kJ��mol-1 | 630 | 243 | a | 607 |
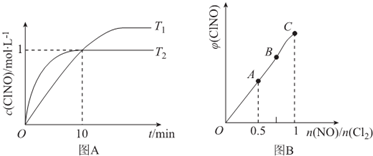
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
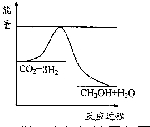
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
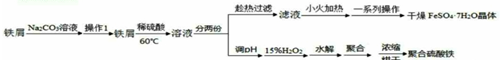
 ��úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������
��úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������| ��ʼ Ũ�� | �� | �� | �� |
| c��H2��/mol/L | 0.010 | 0.020 | 0.020 |
| c��CO2��/mol/L | 0.010 | 0.010 | 0.020 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | CuO�ǻ�ԭ���������� | |
| B�� | H2�ǻ�ԭ���������� | |
| C�� | H2O�Ȳ�����������Ҳ���ǻ�ԭ���� | |
| D�� | Cu�ǻ�ԭ�������ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͭ��Ũ���ᷴӦ��3Cu2+ 8H++2 NO3-�T3Cu2++2NO��+4H2O | |
| B�� | ����ʯ����ᷴӦ��2H++CO32-�TCO2��+H2O | |
| C�� | ��������ϡ���ᷴӦ��2Fe+6H+�T2Fe3++3H2�� | |
| D�� | ����ˮ��Ӧ��2Na+2H2O�T2Na++2OH-+H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com