
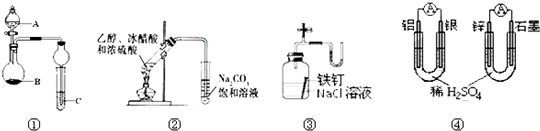
| A、图①中,若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、图②制备乙酸乙酯 |
| C、图③证明铁生锈与空气有关 |
| D、图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:

| 温度 | 平衡浓度/(mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
 电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g D2O含有电子数为9NA |
| B、标准状况下,11.2L乙酸中含有的分子数目为0.5NA |
| C、78g Na2O2中含有的离子总数为4NA |
| D、1L 1mol?L-1 Na2CO3溶液中,溶液中CO32-离子数是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z=3X+2Y |
| B、4Y=2X+Z |
| C、3X=Y+5Z |
| D、6Y=2X+Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol Na被完全氧化生成1mol Na2O2,得到2NA个电子 |
| B、25℃时pH=13的NaOH液中含有OH一的数目为0.1NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
| D、等物质的量的HCN与NaCN混合后溶液显碱件.则溶液中c(CN-)<c(HCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 往溶液中加入淀粉 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号).A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子.短周期元素B的一种常见单质为淡黄色粉末.元素C的原子最外层电子数是其内层电子数的3倍.
A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号).A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子.短周期元素B的一种常见单质为淡黄色粉末.元素C的原子最外层电子数是其内层电子数的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| ⑦ | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH试纸测定浓度为0.1mol?L-1 NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH |
| ⑧ | 验证NaAlO2溶液和NaHCO3溶液都发生了水解反应,且相互促进 | 向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 |
| A、①⑤⑥ | B、②③⑤⑦ |
| C、①④⑤⑦ | D、①②⑤⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com