

 ,故答案为:
,故答案为: .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
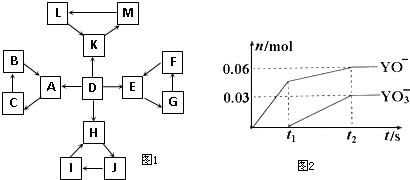
| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水,F用于制备干燥剂以及催化剂的载体 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业生产中的重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
| 7 | K为酸雨的主要成分 |
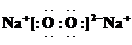
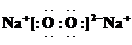
| ||
| ||
查看答案和解析>>
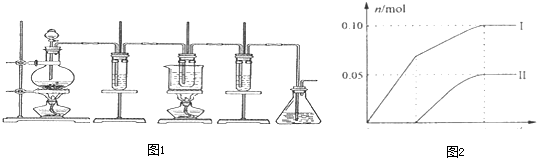
科目:高中化学 来源: 题型:

| t/min | 0 | 5 | 10 |
| AO/mol?L-1 | 1.00 | 0.65 | 0.50 |
| H2/mol?L-1 | 2.00 | 1.00 | |
| AH3OH/mol?L-1 | 0.00 | 0.35 | 0.50 |
查看答案和解析>>
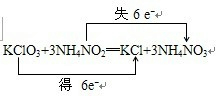
科目:高中化学 来源: 题型:
| △ |
| A、若反应中C和S的质量比为3:4,则n(KClO3):n(CO2)为1:1 |
| B、若反应中C和S的质量比为3:16,则n(KClO3):n(CO2)为2:1 |
| C、SO2通入NaHCO3溶液产生CO2,可证明非金属性S强于C |
| D、KClO3与SO2在强酸性溶液中反应制得ClO2,可证明SO2的还原性强于ClO2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省内江市高三第二次模拟考试理综化学试卷(解析版) 题型:计算题
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:

回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为_______
(2)为了提高钒的浸出率,用酸浸使催化剂中的V2O5转变成可溶于水的VOSO4,与水浸液合并,再用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4。反应①的离子方程式为_______;反应②的离子方程式为ClO3-+6VO2++3H2O=6VO2++6H++Cl-。
(3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。
(4) 实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L-1的KC1O3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V2O5的相对分子质量为182)。
(5) 全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互 转化的装置,其原理如右下图所示。已知电池的总反应式为VO2++V2++2H+ VO2++V3++H2O
VO2++V3++H2O

①放电时的正极反应式为______________。
②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H+)的变化量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com